题目内容
17.已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16.在一定条件下,各物质相互转化关系如图所示:
(1)写出X和G的化学式:XNa2S,GSO3.
(2)写出有关变化的化学方程式:
D+丙:2Na2SO3+O2═2Na2SO4.
C+G:SO3+2NaOH═Na2SO4+H2O.
(3)写出离子方程式B+H2O:2Na2O2+2H2O═4Na++4OH-+O2↑;
若消耗0.5mol B转移电子0.5 mol.
分析 单质甲、乙均能分别与单质丙连续两次反应,可能是单质甲、乙分别被O2连续两次氧化,生成不同的氧化物,则丙是O2.氧化物B与水反应能放出O2,则B是Na2O2,那么C是NaOH,A是Na2O,甲是Na.又因B和X的摩尔质量相同,则X是Na2S,那么乙是S,F是SO2,G是SO3.进一步推出D是Na2SO3,E是Na2SO4,而Na2SO4的相对分子质量比Na2SO3的相对分子质量大16,符合题意,结合对应物质的性质以及题目要求可解答该题.
解答 解:(1)由以上分析可知X为Na2S,G是SO3,故答案为:Na2S;SO3;
(2)D和丙的反应为2Na2SO3+O2=2Na2SO4,C+G的反应为SO3+2NaOH═Na2SO4+H2O,故答案为:2Na2SO3+O2═2Na2SO4;SO3+2NaOH═Na2SO4+H2O;
(3)过氧化钠和水反应生成氢氧化钠和氧气,反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑,反应中O元素的化合价分别变为-1价、0价,0.5mol 过氧化钠可生成0.25mol氧气,则转移0.5mol电子.
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;0.5.
点评 本题考查了无机物的推断,为高频考点,侧重于物质转化关系的综合应用、物质性质的应用、反应现象的判断和特征应用,注意连续氧化的反应类型及应用,掌握常见物质的性质和反应特征、反应条件是解题关键,题目难度中等.

练习册系列答案
相关题目
7.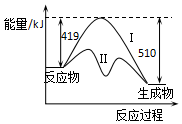 已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
 已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )
已知:CO(g)+2H2(g)?CH3OH(g)△H,反应过程中生成1mol CH3OH(g)的能量变化如图所示.曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况.下列判断正确的是( )| A. | 加入催化剂,△H变小 | |
| B. | △H=+91 kJ/mol | |
| C. | 生成1molCH3OH(l)时,△H值增大 | |
| D. | 反应物的总能量大于生成物的总能量 |
8.下列有关硅及其化合物的说法正确的是( )
| A. | 硅酸钠属于盐不属于碱,所以硅酸钠可保存在磨口塞得试剂瓶中 | |
| B. | 反应 Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| C. | 普通玻璃,石英玻璃,水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分是 Be3Al2Si6O18,用氧化物的形式表示为 3BeO•Al2O3•6SiO2 |
5.某有机化合物D的结构为  ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )| A. | 烃A为乙烯 | |
| B. | 反应①、②、③的反应类型依次为加成反应,取代反应,取代反应 | |
| C. | 反应③为了加快反应速率可以快速升温至170℃度 | |
| D. | 化合物D属于醚 |
12.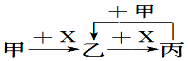 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
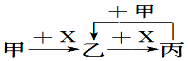 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )| A. | C和O2 | B. | CO2和NaOH溶液 | ||
| C. | Cl2和Fe | D. | AlCl3溶液和NaOH溶液 |
2.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=12的溶液中:Al3+、Na+、CH3COO-、SO32- | |
| B. | 无色溶液中:Cu2+、Ca2+、HSO3-、NO3- | |
| C. | 新制氯水中:NH4+、Fe3+、SO42-、Cl- | |
| D. | 磷酸溶液中:Ba2+、Mg2+、CO32-、Br- |
9.下列有关化学反应速率的说法中,正确的是( )
| A. | 实验事制氢气时,加入少量NaNO3固体,不影响反应速率 | |
| B. | 锌片分别与等pH的醋酸、硫酸反应,平均反应速率相等 | |
| C. | 升高温度后,吸热反应的速率加快,放热反应的速率减慢 | |
| D. | 纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大 |
6.常温下,CaSO4[Ksp(CaSO4)=9×10-6]在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )

| A. | 在任何溶液中,c(Ca2+)•c(SO42-)均相等 | |
| B. | d点溶液通过蒸发可以变到c点 | |
| C. | b点对应的Ksp大于a点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol•L-1 |
11.N4O6是一种新型的火箭推进剂中的氧化剂,燃烧时发生反应N4O6+3N2H4═5N2+6H2O,下列说法正确的是( )
| A. | N4O6的摩尔质量是152 | |
| B. | 该反应为复分解反应 | |
| C. | N4O6为离子化合物 | |
| D. | 该反应中生成标准状况下11.2L N2,转移的电子数为1.2NA |