题目内容
现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SOO42-、NOO3-的相互分离.相应的实验过程可用如图表示:
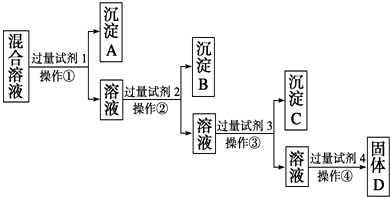
(1)写出上述实验过程中所用试剂的名称:试剂1为
(2)控制试剂4的加入量的方法是
(3)加入过量试剂3的目的是
(4)操作①的名称是
(5)写出加入试剂4后发生反应的化学方程式:

(1)写出上述实验过程中所用试剂的名称:试剂1为
氯化钡溶液(或硝酸钡溶液)
氯化钡溶液(或硝酸钡溶液)
,试剂2为硝酸银溶液
硝酸银溶液
.(2)控制试剂4的加入量的方法是
测定溶液的pH
测定溶液的pH
.(3)加入过量试剂3的目的是
除去溶液中过量的Ba2+、Ag+
除去溶液中过量的Ba2+、Ag+
.(4)操作①的名称是
过滤
过滤
,在加入试剂4后,获得固体D的实验操作④是加热蒸发、冷却结晶、过滤
加热蒸发、冷却结晶、过滤
(填操作名称).(5)写出加入试剂4后发生反应的化学方程式:
Na2CO3+2HNO3═2NaNO3+CO2↑+H2O
Na2CO3+2HNO3═2NaNO3+CO2↑+H2O
.分析:如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3.
解答:解:(1)分离溶液中的Cl-,应加入AgNO3,分离溶液中的SO42-,应加入BaCl2[或Ba(NO3)2],如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,所以试剂1为BaCl2[或Ba(NO3)2],试剂2为AgNO3,试剂3为Na2CO3,试剂4为HNO3,故答案为:BaCl2[或Ba(NO3)2];AgNO3;
(2)硝酸的量不可加入太多,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,
发生:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,可通过测定溶液PH的方法判断反应是否已经完全,
故答案为:测定溶液pH;
(3)加入过量的BaCl2[或Ba(NO3)2],在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,反应后溶液中存在过量的Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,故答案为:除去溶液中过量的Ag+、Ba2+;
(4)分离固体和液体用过滤,操作①的名称是过滤,从溶液中获得固体,应将溶液进行蒸发,然后冷却结晶、最后过滤可得固体,故答案为:过滤;加热蒸发、冷却结晶、过滤.
(5)操作③所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,
故答案为:Na2CO3+2HNO3═2NaNO3+CO2↑+H2O.
(2)硝酸的量不可加入太多,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,
发生:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,可通过测定溶液PH的方法判断反应是否已经完全,
故答案为:测定溶液pH;
(3)加入过量的BaCl2[或Ba(NO3)2],在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,反应后溶液中存在过量的Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,故答案为:除去溶液中过量的Ag+、Ba2+;
(4)分离固体和液体用过滤,操作①的名称是过滤,从溶液中获得固体,应将溶液进行蒸发,然后冷却结晶、最后过滤可得固体,故答案为:过滤;加热蒸发、冷却结晶、过滤.
(5)操作③所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,
故答案为:Na2CO3+2HNO3═2NaNO3+CO2↑+H2O.
点评:本题考查物质的分离提纯操作,题目难度中等,本题注意Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.

练习册系列答案
相关题目