题目内容
2.下列物质中,属于电解质的是( )| A. | Mg | B. | NH4Cl | C. | H2 | D. | NO2 |
分析 根据电解质的定义:电解质是指溶于水溶液中或在熔融状态下就能够导电(电解离成阳离子与阴离子)并产生化学变化的化合物来解答此题
解答 解:A.Mg为金属单质,不是化合物,不是电解质,故A错误;
B.氯化铵是盐,水溶液中电离,溶液导电,所以氯化铵属于电解质,故B正确;
C.氢气是单质,不是化合物,不是电解质,故C错误;
D.二氧化氮本身不能电离出离子,所以此化合物为非电解质,故D错误;
故选B.
点评 本题考查了电解质、非电解质概念实质理解,把握电解质的定义主要有两点:溶于水溶液中或在熔融状态下就能够导电,即是以离子的形式分散在水中,二是该物质是化合物,题目难度不大.

练习册系列答案
相关题目
12.下列叙述中,正确的是( )
| A. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 两原子的核外电子排布相同,则一定属于同种元素 | |
| D. | 一种阳离子和一种阴离子的质子数和电子数可能同时相等 |
13.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
| A. | 1.0 L 1 mol•L-1氨水中,NH3•H2O的分子数为6.02×1023 | |
| B. | 当有7.1 g Cl2和水完全反应时转移的电子数为0.1×6.02×1023 | |
| C. | 白磷分子(P4)呈正四面体结构,31 g白磷中含有P-P键个数为6×6.02×1023 | |
| D. | 20 g重水(2H216O)中含有的中子数为8×6.02×1023 |
10.对下列各组物质性质的比较中,正确的是( )
| A. | 熔点:纯铁>生铁 | B. | 密度:乙酸乙酯>硝基苯 | ||
| C. | 最高正化合价:F>N | D. | 热稳定性:NaHCO3>Na2CO3 |
17.下列说法正确的是( )
| A. | 物质的量是物质所含微粒的数量 | |
| B. | 阿伏加德罗常数是人们规定的数,没有单位 | |
| C. | H2的摩尔质量等于NA个H2的质量之和 | |
| D. | 标准状况下,H2的摩尔体积为22.4 L•mol-1 |
7.下列离子方程式中,正确的是( )
| A. | 硫酸与碳酸钡反应:CO32-+2H+═CO2↑+H2O | |
| B. | 向氯化铜溶液中加入氢氧化钠溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++Cl- |
14.下列各组物质中,不互为同素异形体的是( )
| A. | 金刚石和C60 | B. | 红磷和P4 | C. | O2和O3 | D. | CH3CH3和CH4 |
11.下列物质中,既含有氯分子,又含有氯离子的是( )
| A. | 氯化钠溶液 | B. | 新制氯水 | C. | 漂白粉 | D. | 液氯 |

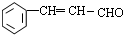 .
.