题目内容
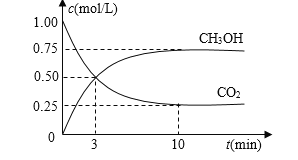
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是

A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
【答案】B
【解析】
A. 由各微粒分布曲线图知,![]() 时,
时,![]() 与
与![]() 的浓度相同,且二者的分布系数均为
的浓度相同,且二者的分布系数均为![]() ,可得
,可得![]() ,故A正确;
,故A正确;
B.![]() 的水解反应为
的水解反应为![]() ,由图中第二个交点可求出
,由图中第二个交点可求出![]() 的电离平衡常数为
的电离平衡常数为![]() ,
,![]() 的水解平衡常数为
的水解平衡常数为 ,故
,故![]() 的水解程度小于
的水解程度小于![]() 的电离程度,等物质的量的
的电离程度,等物质的量的![]() 、
、![]() 溶于水中,
溶于水中,![]() ,
,![]() ,故B错误;
,故B错误;
C. 类似于A项的分析,可以推算出反应![]() 的平衡常数
的平衡常数![]() ,根据强酸制弱酸原理可得
,根据强酸制弱酸原理可得![]() ,故C正确;
,故C正确;
D. ![]() 的水解平衡
的水解平衡![]()
的平衡常数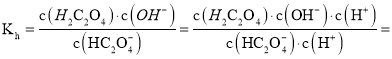
![]() ,说明
,说明![]() 的电离程度大于其水解程度,故
的电离程度大于其水解程度,故![]() 溶液中:
溶液中:![]() ,故D正确。
,故D正确。
故选B。

练习册系列答案
相关题目