题目内容
表示0.1mol·L-1 NaHCO3溶液中有关微粒浓度(mol·L-1)的关系式,正确的是
[ ]
A.[Na+]> >
> >[H+]>[OH-]
>[H+]>[OH-]
B.[Na+]+[H+]= +
+ +[OH-]
+[OH-]
C.[Na+]+[H+]= +2
+2 +[OH-]
+[OH-]
D.[Na+]= +
+ +[H2CO3]
+[H2CO3]
答案:CD
解析:
提示:
解析:
|
【巧解导析】在NaHCO3溶液中,除了H2O的电离外,还存在下列电离: NaHCO3 另外还存在水解反应: |
提示:
|
【巧解点悟】解题关键点是除了要清楚溶液中的两种守恒:电荷守恒、物料守恒外,还应对溶液中的主要矛盾与次要矛盾(从影响溶液酸碱性角度)区分清楚; |

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
室温时,下列各表述与示意图一致的是( )
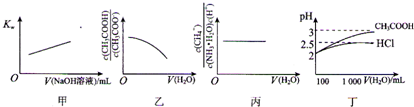

| A、图甲表示在纯水中加入0.01 moL?L-1 NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1 NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mL pH=2的HCl和CH3COOH加水稀释到1000mL时pH变化与水的体积的变化关系 |
 Na++
Na++ (完全电离)
(完全电离) H++
H++ (只是微弱电离)
(只是微弱电离) ,H2CO3,其中以
,H2CO3,其中以