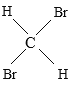
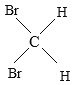
题目内容
【题目】Ⅰ.ClO2 是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 ClO2:2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中还原剂的化学式是 __________;被还原元素的元素符号是 _________ ;
(2)试比较 KClO3 和 CO2 的氧化性强弱 ____________________________________;
(3)消毒时,ClO2 还可以将水中的 Fe2+ 、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,此过程说明 ClO2 具有 ___________ ( 填“氧化”或“还原” ) 性;
(4)当转移 0.2mol 电子时,生成的ClO2在标准状况下的体积为 ___________________。
Ⅱ.根据已学知识回答下列问题:
(1)在反应 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为________。
(2)2FeS+ 6H2SO4(浓)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
(3)配平下面两个反应:
① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:______________________________________。
【答案】H2C2O4 Cl KClO3 > CO2 氧化 4.48L 1:5 2:3 2 1 1 1 2 2 16 2 2 5 8 2KMnO4 +5SO2 + 2H2O = K2SO4 + 2MnSO4 +2 H2SO4
【解析】
Ⅰ(1)2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,分析化合价,KClO3中氯化合价降低,H2C2O4中碳化合价升高,因此还原剂的化学式是H2C2O4;被还原元素的元素符号是Cl,故答案为:H2C2O4;Cl。
(2)根据氧化剂的氧化性大于氧化产物的氧化性,可得KClO3和CO2的氧化性强弱是KClO3 > CO2,故答案为:KClO3 > CO2。
(3)消毒时,Fe2+、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,化合价升高,则ClO2化合价降低,说明ClO2具有氧化性,故答案为:氧化。
(4)KClO3中氯化合价由+5价变为+4价,2mol KClO3转移2mol电子生成2molClO2,当转移0.2mol电子时,生成0.2molClO2,在标准状况下的体积为0.2mol×22.4L/mol = 4.48L,故答案为:4.48L。
Ⅱ(1)在反应KIO3 + 6HI=3I2 + KI + 3H2O中,KIO3化合价降低,作氧化剂,HI化合价升高,作还原剂,但只有5molKI升高,因此氧化剂与还原剂的物质的量之比为1:5,故答案为:1:5。
(2)2FeS+ 6H2SO4(浓)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中FeS中硫化合价升高变为单质硫,发生氧化反应,物质的量为2mol,H2SO4中硫化合价降低,有3mol硫降低,发生还原反应,因此发生氧化反应和发生还原反应的硫元素物质的量之比为2:3,故答案为:2:3。
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中FeS中硫化合价升高变为单质硫,发生氧化反应,物质的量为2mol,H2SO4中硫化合价降低,有3mol硫降低,发生还原反应,因此发生氧化反应和发生还原反应的硫元素物质的量之比为2:3,故答案为:2:3。
(3) ①氯气化合价降低2,二氧化硫化合价升高2,因此根据得失电子守恒和质量守恒得到:2H2O +1Cl2 +1SO2 ==1H2SO4 +2HCl,故答案为:2;1;1;1;2。
②高锰酸钾降低5,生成氯气升高2,根据得失电子守恒和质量守恒得到:
2KMnO4 + 16HCl=2KCl + 2MnCl2 + 5Cl2↑ + 8H2O,故答案为:2;16;2;2;5;8。
根据以上两个反应反应,高锰酸钾表现强的氧化性,二氧化硫表现强的还原性,因此高锰酸钾和二氧化硫发生氧化还原反应,2KMnO4 +5SO2 + 2H2O = K2SO4 + 2MnSO4+2H2SO4,故答案为:2KMnO4 +5SO2 + 2H2O = K2SO4 + 2MnSO4 +2 H2SO4。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
请回答下列问题:
(1)列出CH3COONa的水解平衡常数Kh的计算式:_________。
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是___<___< ____(用编号填写)。
(3)写出向NaClO溶液中通入少量CO2的化学方程式________。
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:_____________。(写出离子方程式)。0.01mol/L Na2CO3溶液的pH___0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“=”)
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为_______。