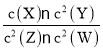题目内容
【题目】可逆反应3A(g)+B(g)![]() 4C(g)达平衡的是( )
4C(g)达平衡的是( )
A.单位时间内消耗amolB,同时生成3amolA
B.容器内压强不再变化
C.混合气体的总物质的量不再发生变化
D.3v(A)=v(B)=4v(C)
【答案】A
【解析】
A.单位时间内消耗amolB,同时生成3amolA ,说明B分解速率与A生成速率之比等于化学计量数之比,体现了正逆反应速率相等,故A正确;
B.反应前后气体物质的量相同,压强始终不变,所以压强不变不能说明反应达到平衡状态,故B错误;
C.反应前后气体的计量数之和相同,则恒温恒容条件下,容器内气体物质的量始终不变,这不能说明正逆反应速率相等,不能说明反应达到平衡状态,故C错误;
D.速率之比始终等于化学计量数之比,与是否平衡无关,故D错误;
故答案为A。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V,根据相关数据所绘制的图象如图所示,则曲线a、b、c、d所对应的实验组别可能依次是( )

实验组别 | c(HCl)/(mol·L-1) | 温度/℃ | 形状(Fe) |
1 | 2.0 | 30 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.4、3、2、1B.1、2、3、4
C.3、4、2、1D.1、2、4、3