题目内容
25℃时,将pH=9的Ba(OH)2溶液和pH=12的KOH溶液按4:1的体积比混合,在混合液中c(H+)为( )
A、
| ||
B、
| ||
| C、5×10-12mol/L | ||
| D、5×(10-9+10-12)mol/L |
分析:计算出碱溶液混合后的c(OH-),根据Kw=c(OH-)×c(H+)=10-14,可计算出c(H+).
解答:解:pH=9的Ba(OH)2溶液中c(OH-)=10-5mol/L,pH=12的KOH溶液中c(OH-)=10-2mol/L,
按4:1的体积比混合,c(OH-)=
mol/L≈0.2×10-2mol/L,
则c(H+)=
=5×10-12mol/L,
故选C.
按4:1的体积比混合,c(OH-)=
| 4×10-5+10-2 |
| 5 |
则c(H+)=
| 1×10-14 |
| 0.2×10-2 |
故选C.
点评:本题考查pH的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握计算的相关公式的运用以及解题思路的梳理,难度不大.

练习册系列答案
相关题目
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: 已知水在25℃和99℃时,其电离平衡曲线如图所示:
已知水在25℃和99℃时,其电离平衡曲线如图所示: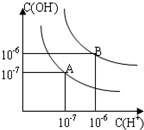 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: