题目内容
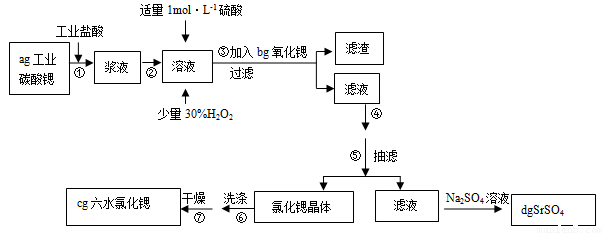
六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主成分为SrSO4)为原料制备,生产流程如下:

(1)第①步反应前天青石先研磨粉碎,其目的是________________。
第③步加入适量稀硫酸的目的是______ _。
(2)第①步反应若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:________________________________________。
(3)第④步操作依次是蒸发浓缩、冷却结晶、过滤、________、_______。
(4)称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(产品中不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的KSCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。若滴定过程用去上述浓度的KSCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为________(保留4位有效数字)。
(1)增加反应物的接触面积,提高反应速率,提高原料的利用率。(2分)
除去溶液中Ba2+杂质(2分)
(2)SrSO4 + 4C = SrS + 4CO(3分) (3)洗涤、干燥(或烘干)(各1分,共2分)
(4) 93.45%(4分)
【解析】
试题分析:(1)把固体反应物研磨粉碎,可增加反应物的接触面积,提高反应速率,提高原料的利用率;第②步所得溶液含有少量Ba2+,所以第③步加入适量稀硫酸目的是:除去溶液中Ba2+杂质。
(2)0.5 mol SrSO4中只有S被还原,转移了4 mol电子,说明S化合价降低了8价,转化为SrS,根据流程图C转化为CO,化学方程式为:SrSO4 + 4C = SrS + 4CO
(3)要得到纯净的固体,蒸发浓缩、冷却结晶、过滤后,需要进行洗涤、干燥(或烘干)操作。
(4)根据各步反应得出关系式: 2AgNO3 ~ 2KSCN ,剩余的n(AgNO3)=2n(KSCN)= 0.2000 mol/L×0.02L=0.004mol, 根据SrCl2·6H2O ~ 2AgNO3 ,则产品中SrCl2·6H2O的质量百分含量为:1/2×(1.100×10-2 mol -0.004mol)×267g/mol÷1.000g×100% =93.45%
考点:本题考查实验中基本操作、化学流程的分析、化学方程式的书写、质量分数的计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
|
|
SrSO4 |
BaSO4 |
Sr(OH)2 |
|
Ksp |
3.3×10—7 |
1.1×10—10 |
3.2×10—4 |