题目内容
|
下列说法错误的是 | |
| [ ] | |
A. |
在氧化还原反应中,得到电子的元素化合价升高 |
B. |
物质中某元素得到电子的反应是还原反应 |
C. |
物质中某元素得到电子被还原,则此物质是氧化剂,它在反应中表现氧化性 |
D. |
还原剂的某元素在反应中被氧化后得到的是氧化产物 |
答案:A
解析:
解析:
|
根据氧化还原反应的有关概念,可以知道在氧化还原反应中,得电子的物质,所含元素化合价降低,被还原,其本身为氧化剂,表现氧化性,发生还原反应,反应后得到的产物为还原产物.由此可知,选项A错误,B、C、D正确. |

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
如表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是( )
|
如图为元素周期表中短周期的一部分,下列说法错误的是( )
| X | Y |
| Z | W |
| A、Z的原子序数可能是X的两倍 |
| B、单质的活泼性可能是Y<Z |
| C、X、Z的最高价氧化物对应水化物可能均为强酸 |
| D、分别由Y、W形成的单质可能都是原子晶体 |
化学反应原理中涉及很多常数,下列说法错误的是( )
A、反应N2(g)+3H2(g)
| |||||
| B、化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 | |||||
| C、对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 | |||||
| D、将AgNO3溶液和KCl溶液混合后,若c(Ag+)?c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
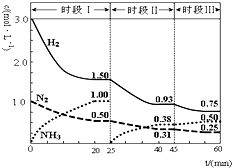 N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )| A、前20分钟反应物的转化率为50% | B、第25分钟改变的条件是将NH3从反应体系中分离出去 | C、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数增大 | D、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |