题目内容
(2013?烟台模拟)氯化钠、乙烯是化学工业的重要原料.
(1)工业上由NaCl制Na的化学方程式为
(2)如图为电解食盐水与乙烯和Cl2加成制l,2-=氯乙烷的联合装置示意图:
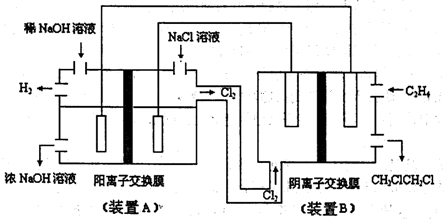
在该装置中,
(3)常温下,NaHCO3溶液中存在的质子守恒关系式为:c(OH-)+
加热0.5mol?L-1NaHCO3溶液,使NaHCO380%分解,然后恢复至室温.假设反应前后溶液的体积不变,则反应后的溶液中c(CO2-3)+c(HCO3+c(H2CO3)=
(1)工业上由NaCl制Na的化学方程式为
2NaCl
2Na+Cl2↑
| ||
| 熔融 |
2NaCl
2Na+Cl2↑
;实验室中金属钠应保存在盛有
| ||
| 熔融 |
煤油
煤油
的广口瓶中;若将一小块钠长期暴露在空气中,最终钠将转化为Na2CO3
Na2CO3
.(2)如图为电解食盐水与乙烯和Cl2加成制l,2-=氯乙烷的联合装置示意图:

在该装置中,
B
B
为原电池(填“A”或“B”)提供电能,其负极的电极反应式为C2H4+2Cl-+2e-=CH2ClCH2Cl
C2H4+2Cl-+2e-=CH2ClCH2Cl
.在A装置中,阳离子交换膜的作用是传导钠离子、氢离子形成闭合回路,防止氢气和氯气及氯气和氢氧化钠接触而发生副反应
传导钠离子、氢离子形成闭合回路,防止氢气和氯气及氯气和氢氧化钠接触而发生副反应
.(3)常温下,NaHCO3溶液中存在的质子守恒关系式为:c(OH-)+
c(CO32-)
c(CO32-)
=c(H+)+c(H2CO3);加热0.5mol?L-1NaHCO3溶液,使NaHCO380%分解,然后恢复至室温.假设反应前后溶液的体积不变,则反应后的溶液中c(CO2-3)+c(HCO3+c(H2CO3)=
0.3
0.3
_mol?L-1.分析:(1)活泼金属采用电解其熔融盐的方法冶炼,钠易和氧气、水反应,所以保存钠要隔绝空气和水,根据根据Na、Na2O、NaOH以及Na2CO3等物质的性质分析;
(2)电解饱和食盐水需要外接电源,则B装置有电流产生,则B是原电池,负极上失电子发生氧化反应,根据得失电子判断负极上的反应,在A装置中,阳离子交换膜的作用是传导钠离子、氢离子形成闭合回路,防止副反应发生;
(3)根据物料守恒和电荷守恒判断,加热后溶液中碳酸氢钠的浓度是0.5mol?L-1(1-80%)=0.1mol/L,碳酸钠的物质的量浓度=0.5mol?L-1×80%×
=0.2mol/L,根据物料守恒判断.
(2)电解饱和食盐水需要外接电源,则B装置有电流产生,则B是原电池,负极上失电子发生氧化反应,根据得失电子判断负极上的反应,在A装置中,阳离子交换膜的作用是传导钠离子、氢离子形成闭合回路,防止副反应发生;
(3)根据物料守恒和电荷守恒判断,加热后溶液中碳酸氢钠的浓度是0.5mol?L-1(1-80%)=0.1mol/L,碳酸钠的物质的量浓度=0.5mol?L-1×80%×
| 1 |
| 2 |
解答:解:(1)工业上由NaCl制Na采用电解熔融氯化钠的方法冶炼,其反应方程式为:2NaCl
2Na+Cl2↑,钠和氧气、水易反应,且钠的密度大于煤油,所以实验室中金属钠应保存在盛有煤油的广口瓶中Na的性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3?xH2O,Na2CO3?xH2O风化脱水生成Na2CO3,
故答案为:2NaCl
2Na+Cl2↑;煤油;Na2CO3;
(2)电解饱和食盐水需要外接电源,则B装置有电流产生,则B是原电池,原电池的负极上乙烯失电子和氯离子反应生成l,2-二氯乙烷,电极反应式为:C2H4+2Cl-+2e-=CH2ClCH2Cl,在A装置中,阳离子交换膜的作用是:传导钠离子、氢离子形成闭合回路,防止氢气和氯气及氯气和氢氧化钠接触而发生副反应,
故答案为:B;C2H4+2Cl-+2e-=CH2ClCH2Cl;传导钠离子、氢离子形成闭合回路,防止氢气和氯气及氯气和氢氧化钠接触而发生副反应;
(3)根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)①,根据物料守恒得
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)②,将②带人①得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),
加热后溶液中碳酸氢钠的浓度是0.5mol?L-1(1-80%)=0.1mol/L,碳酸钠的物质的量浓度=0.5mol?L-1×80%×
=0.2mol/L,根据物料守恒得c(HCO3-)+c(CO32-)+c(H2CO3)=(0.1+0.2)mol/L=0.3mol/L,
故答案为:c(CO32-);0.3.
| ||
| 熔融 |
故答案为:2NaCl
| ||
| 熔融 |
(2)电解饱和食盐水需要外接电源,则B装置有电流产生,则B是原电池,原电池的负极上乙烯失电子和氯离子反应生成l,2-二氯乙烷,电极反应式为:C2H4+2Cl-+2e-=CH2ClCH2Cl,在A装置中,阳离子交换膜的作用是:传导钠离子、氢离子形成闭合回路,防止氢气和氯气及氯气和氢氧化钠接触而发生副反应,
故答案为:B;C2H4+2Cl-+2e-=CH2ClCH2Cl;传导钠离子、氢离子形成闭合回路,防止氢气和氯气及氯气和氢氧化钠接触而发生副反应;
(3)根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)①,根据物料守恒得
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)②,将②带人①得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),
加热后溶液中碳酸氢钠的浓度是0.5mol?L-1(1-80%)=0.1mol/L,碳酸钠的物质的量浓度=0.5mol?L-1×80%×
| 1 |
| 2 |
故答案为:c(CO32-);0.3.
点评:本题涉及钠的性质、原电池和电解池原理、离子浓度大小的比较等知识点,离子浓度大小的判断中要根据物料守恒和电荷守恒来分析,是学习的难点.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目