题目内容
5. 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子(使重金属离子形成硫化物沉淀除去).
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解(或除去甲酸).最后经结晶分离、干燥得产品.
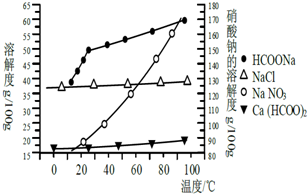
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属 离子 | 开始沉淀 的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,
并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
分析 Ⅰ.(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率;
(2)温度较高时,双氧水易分解,甲醛易挥发;
(3)重金属离子与硫离子反应生成难溶的硫化物;
(4)搅拌是使反应物充分接触;甲酸钙水解显碱性,溶液为弱碱性能抑制其水解;
Ⅱ.该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节),然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出.
解答 解:Ⅰ.(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率,则加过量的过氧化氢能使甲醛充分氧化,提高甲醛的利用率和产品纯度,故答案为:使甲醛充分氧化,提高甲醛的利用率和产品纯度;
(2)温度较高时,双氧水易分解,甲醛易挥发,则反应温度最好控制在30-70℃之间,温度不易过高,能防止H2O2分解和甲醛挥发,故答案为:防止H2O2分解和甲醛挥发;
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,硫化钠与重金属离子结合生成硫化物,硫化物难溶于水,可以除去重金属离子,故答案为:除去重金属离子;
(4)搅拌是使使反应物充分接触,使其反应完全,提高产率;甲酸根离子为弱酸根离子,则甲酸钙水解显弱碱性,调节溶液pH 7~8,溶液为弱碱性能抑制甲酸钙水解,故答案为:使反应物充分接触,提高产率;防止甲酸钙水解;
Ⅱ.该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出,故答案为:步骤2.用稍过量硝酸溶解碳酸钙样品,步骤3.用石灰水调整溶液pH=5,步骤4.趁热过滤.
点评 本题主要考查了物质的制备、除杂质、提高产率的方法、实验方案设计等,为高频考点,明确实验目的及实验原理为解答关键,试题培养了学生的分析能力及化学实验能力,难点是II中制备步骤设计,根据I采用知识迁移的方法设计II,题目难度较大.

①放出的气体中除SO2外还有H2;
②反应结束时转移的电子的总物质的量为4mol;
③只放出SO2气体,其物质的量为1mol;
④反应结束后加入KNO3固体Zn粉继续溶解.
| A. | 只有① | B. | 只有② | C. | 只有③ | D. | 只有②③④ |
| A. | 甲为氯化钡 | B. | 乙溶液含有Cl- | ||
| C. | 丙溶液含有 SO42- | D. | 丁溶液含有NH4+ |
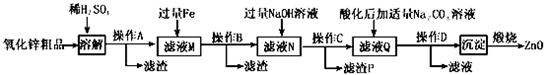
已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的体积(mL) | 672 | 840 | 896 | 672 |
(2)盐酸的物质的量浓度c(HCl)=2.5mol/L.
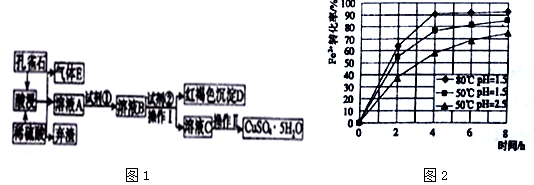
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如表所示:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
(1)弃渣的主要成分是SiO2,Ⅱ中有“洗涤”的操作,其目的是除去晶体表面附着的杂质.
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,则试剂①最好为下列中的b,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
a.Na2O2b.H2O2 c.Cl2 d.KSCN
(3)根据图2有关数据,你认为工业上氧化操作时应采取措施将反应温度及溶液pH分别控制在80℃,pH=1.5,氧化时间为4h左右.
(4)操作Ⅰ中溶液的pH应控制在3.2≤pH<4.7范围内.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液进行滴定,则KMnO4溶液应置于酸(填“酸”或“碱”)式滴定管中.若滴定20.00mLA的溶液,用去0.0240mol•L-1KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+的浓度为0.096mol/L.

 ②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点).
②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点). .
.