题目内容
下列说法不正确的是(设NA为阿伏加德罗常数的数值)
- A.20g重水含有10NA个电子
- B.1L 0.1 mol?L-1 Na2SO3溶液中含有的SO32-数目少于0.1NA个
- C.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
- D.用足量铜粉除去FeCl2溶液中的FeCl3杂质
D
分析:A.根据n= 计算20g重水的物质的量,每个重水分子含有10个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;
计算20g重水的物质的量,每个重水分子含有10个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;
B.SO32-在溶液中发生水解,浓度小于0.1mol/L,根据n=cV、N=nNA进行判断;
C.俯视刻度线,液面在刻度线下方,所配溶液的体积偏小,结合c= 判断;
判断;
D.引入新的杂质铜离子.
解答:A.20g重水的物质的量为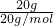 =1mol,每个重水分子含有10个电子,含有电子物质的量为10mol,故含有电子数目为10mol×NAmol-1=10NA,故A正确;
=1mol,每个重水分子含有10个电子,含有电子物质的量为10mol,故含有电子数目为10mol×NAmol-1=10NA,故A正确;
B.SO32-在溶液中发生水解,浓度小于0.1mol/L,SO32-的物质的量小于0.1mol/L×1L=0.1mol,故SO32-数目小于0.1mol×NAmol-1=0.1NA,故B正确;
C.俯视刻度线,液面在刻度线下方,所配溶液的体积偏小,由c= 可知所配溶液的浓度偏高,故C正确;
可知所配溶液的浓度偏高,故C正确;
D.铜与氯化铁反应生成氯化亚铁与氯化铁,引入新的杂质铜离子,故D错误;
故选D.
点评:本题考查常用化学计量的有关计算、溶液配制误差分析、物质提纯等,B选项注意考虑盐类水解,D选项注意除杂原则.
分析:A.根据n=
 计算20g重水的物质的量,每个重水分子含有10个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;
计算20g重水的物质的量,每个重水分子含有10个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;B.SO32-在溶液中发生水解,浓度小于0.1mol/L,根据n=cV、N=nNA进行判断;
C.俯视刻度线,液面在刻度线下方,所配溶液的体积偏小,结合c=
 判断;
判断;D.引入新的杂质铜离子.
解答:A.20g重水的物质的量为
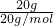 =1mol,每个重水分子含有10个电子,含有电子物质的量为10mol,故含有电子数目为10mol×NAmol-1=10NA,故A正确;
=1mol,每个重水分子含有10个电子,含有电子物质的量为10mol,故含有电子数目为10mol×NAmol-1=10NA,故A正确;B.SO32-在溶液中发生水解,浓度小于0.1mol/L,SO32-的物质的量小于0.1mol/L×1L=0.1mol,故SO32-数目小于0.1mol×NAmol-1=0.1NA,故B正确;
C.俯视刻度线,液面在刻度线下方,所配溶液的体积偏小,由c=
 可知所配溶液的浓度偏高,故C正确;
可知所配溶液的浓度偏高,故C正确;D.铜与氯化铁反应生成氯化亚铁与氯化铁,引入新的杂质铜离子,故D错误;
故选D.
点评:本题考查常用化学计量的有关计算、溶液配制误差分析、物质提纯等,B选项注意考虑盐类水解,D选项注意除杂原则.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 甲、乙是由短周期元素组成的常见物质或微粒,在中学化学中有许多物质或微粒能满足如图相互转化关系,下列说法不正确的是( )
甲、乙是由短周期元素组成的常见物质或微粒,在中学化学中有许多物质或微粒能满足如图相互转化关系,下列说法不正确的是( )