题目内容
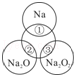
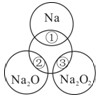 如图所示,两圆圈相交的部分表示圆圈内的物质之间能发生反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质之间能发生反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A、图中正中央圆圈代表的物质是氢氧化钠 | B、反应②的离子方程式为:O2-+H2O=2OH- | C、将反应①、③产生的气体收集混合并点燃可以产生图中正中央圆圈所代表的物质0.05mol,则③反应的还原产物为O2 | D、①、②充分反应后所得溶液的质量分数:②>① |
分析:A、根据两圆圈相交的部分表示圆圈内的物质之间能发生反应来确定物质;
B、在离子方程式中,氧化物、过氧化物都不能拆成离子;
C、根据氢气和氧气之间的燃烧反应结合过氧化钠和水之间的反应来判断即可;
D、根据固体的物质的量计算溶液中溶质的质量、溶液的质量,根据质量分数公式判断质量分数相对大小.
B、在离子方程式中,氧化物、过氧化物都不能拆成离子;
C、根据氢气和氧气之间的燃烧反应结合过氧化钠和水之间的反应来判断即可;
D、根据固体的物质的量计算溶液中溶质的质量、溶液的质量,根据质量分数公式判断质量分数相对大小.
解答:解:A、图中正中央圆圈代表的物质是水,故A错误;
B、反应②的离子方程式为:Na2O+H2O=2Na++2OH-,故B错误;
C、①的反应为:2Na+2H2O=2Na++2OH-+H2↑,②反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,钠及其氧化物的物质的量均为0.1mol,产生的氢气和氧气的量分别是0.05mol,0.05mol,二者燃烧得到水的物质的量是0.05mol,根据反应:2Na2O2+2H2O=4NaOH+O2↑,反应的氧化产物为O2,故C错误;
D、钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+
H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
所以溶液增加的质量大小顺序为:钠<氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠分别溶于水所得溶液的质量分数分别为:
、
,所以①、②充分反应后所得溶液的质量分数:①<②,故D正确.
故选D.
B、反应②的离子方程式为:Na2O+H2O=2Na++2OH-,故B错误;
C、①的反应为:2Na+2H2O=2Na++2OH-+H2↑,②反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,钠及其氧化物的物质的量均为0.1mol,产生的氢气和氧气的量分别是0.05mol,0.05mol,二者燃烧得到水的物质的量是0.05mol,根据反应:2Na2O2+2H2O=4NaOH+O2↑,反应的氧化产物为O2,故C错误;
D、钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+
| 1 |
| 2 |
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
所以溶液增加的质量大小顺序为:钠<氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠分别溶于水所得溶液的质量分数分别为:
| 4g |
| 100g+2.2g |
| 8g |
| 100g+6.2g |
故选D.
点评:本题考查了钠及其化合物的性质,易错选项是D,此为易错点,注意知识的归纳和整理以及灵活应用是关键,难度不大.

练习册系列答案
相关题目
如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )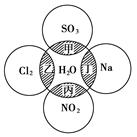
| A.甲、乙 | B.甲、丙 | C.乙、丙 | D.丙、丁 |
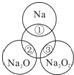 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )