题目内容
有一种银锌电池.其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为Zn-2e-+2OH-=ZnO+H2O Ag2O+2e-+H2O=2Ag+2OH-
下列各项中正确的是( )
下列各项中正确的是( )
| A.银锌电池是一种低能电池 |
| B.在使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.原电池工作时,负极区溶液PH增大 |
| D.Zn电极发生氧化反应,Ag2O电极发生还原反应 |
A、银锌电池是一种高能电池,故A错误;
B、由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故B错误;
C、原电池放电时,负极上锌失电子和氢氧根离子反应生成氧化锌和水,导致负极附近氢氧根离子浓度降低,溶液的
PH值减小,故C错误;
D、由电极反应式知,负极上锌失电子发生氧化反应,正极上氧化银得电子发生还原反应,故D正确.
故选D.
B、由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故B错误;
C、原电池放电时,负极上锌失电子和氢氧根离子反应生成氧化锌和水,导致负极附近氢氧根离子浓度降低,溶液的
PH值减小,故C错误;
D、由电极反应式知,负极上锌失电子发生氧化反应,正极上氧化银得电子发生还原反应,故D正确.
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
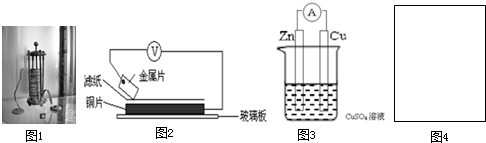
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极. 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);


