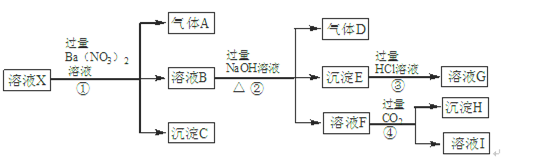
题目内容
硅孔雀石是一种含铜的矿石,含铜形态为
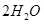 ,同时含有
,同时含有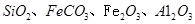 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图: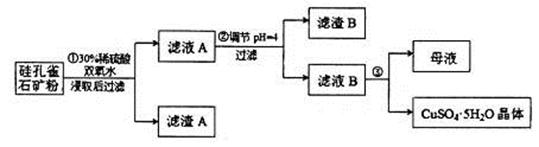
请回答下列问题:
(1)完成步骤①中稀硫酸与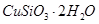 发生反应的化学方程式
发生反应的化学方程式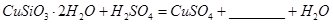 ;
;
用离子方程式表示双氧水的作用_____________________________。
(2)步骤②调节溶液pH选用的最佳试剂是__________________
A. | B.CuO | C.A12O3 | D.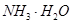 |
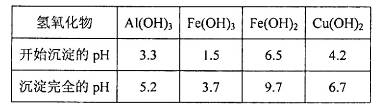
由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到
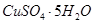 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,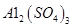 饱和溶液中
饱和溶液中 mol
mol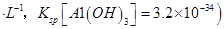 ______________。
______________。(5)若要测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、 “偏低”或“不变”)。
(1)H4SiO4(1分) 2Fe2++H2O2+2H+= 2Fe3++2H2O(2分)
(2)B(2分)
(3)Fe3+(2分),Al3+(2分)
(4)该同学的观点是错误的(1分)通过计算可知,滤液B中C(Al3+)=3.2×10-4 mol?L-1,浓缩后C(Al3+)=6.4×10-4 mol?L-1《2.25 mol?L-1,所以不会有硫酸铝晶体洗出。(2分)
(5)坩埚(1分)偏低(1分)
解析试题分析:(1)根据原子守恒可知缺H4SiO4,孔雀石酸溶后有Fe2+,双氧水有强氧化性,发生氧化还原反应: 2Fe2++H2O2+2H+= 2Fe3++2H2O;(2)调节pH=4的目的是沉淀Fe3+,最后得到硫酸铜晶体,为不引入杂质,选择B;(3)结合表中所给数据分析;(4)该同学的观点是错误的,通过计算可知,滤液B中C(Al3+)=3.2×10-4 mol?L-1,浓缩后C(Al3+)=6.4×10-4 mol?L-1《2.25 mol?L-1,所以不会有硫酸铝晶体洗出;(5)坩埚,硫酸铜在空气中中冷却后吸收了部分水,导致质量增大,测得结晶水含量偏低。
考点:考查化学与生产工艺、定量分析。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ,加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是_______________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:
1MnO4—+Fe2++________===1Mn2++Fe3++________
(3)已知:
生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的:________________________。
(4)已知:一定条件下,MnO4—可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________________________。
④Ⅳ中加入MnSO4的目的是__________________________。
正三价铁元素有一定的氧化性,FeCl3溶液吸收一定量SO2后溶液颜色发生变化。
(1)反应的离子方程式为_________________________________________________。
(2)除H+,OH-,H2O外,溶液中一定含有的微粒有________。
| A.Fe2+ | B.Fe3+ | C.Cl- | D.SO42— E.H2SO3 |
假设1:只存在Fe3+;
假设2:只存在______________________________________________________;
假设3:_____________________________________________________________。
(4)设计实验方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂:3 mol·L-1H2SO4,1 mol·L-1NaOH,0.01 mol·L-1KMnO4,
20%KSCN,3%H2O2,淀粉KI溶液、紫色石蕊试液、品红溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO3—、SO42—、CO32—、HCO3—、MnO4—。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH4+。
将该白色粉末进行下列实验,观察到的现象如下:
| 实验操作 | 现象 |
| a.取少量粉末,加水、振荡 | 全部溶解、 |
| 溶液无色透明 | |
| b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
| c.取少量粉末,加盐酸 | 无明显现象 |
| d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有______________(填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有_____________________________________。
(3)从c实验中,可推断粉末中不可能有________________________________。
(4)从d实验中,可推断粉末中不可能有________,一定含有________。
(5)以上各实验仍无法确定是否存在的离子是____________。
1 L 某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、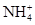 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、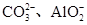 |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是________________。

(2)BC段的离子方程式为__________________________。
(3)V1、V2与V3、V4之间的关系为____________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为____________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_________________。

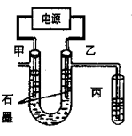
 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: