题目内容
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
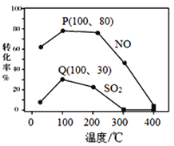
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_____________________________________________________________________________。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
C.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是___________;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
【答案】2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270 kJ·mol1 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 CD 1.4 mol 0.06mol/(L·min) 8
【解析】
(1)燃烧热是指101kPa,1mol可燃物完全燃烧生成稳定氧化物放出的热量,写热化学方程式,根据盖斯定律计算得到CO还原SO2的生成CO2和S(s)热化学方程式;
(2)①反应活化能越小反应越容易进行;
②A.图象为反应相同时间t后的转化率,反应经历时间t后,并不一定达到化学平衡;
B.其它条件不变,若扩大反应器的容积,相当于对反应减压,考虑到O3的分解反应,利于臭氧分解为O2,O3浓度减小,不利于反应正向进行;
C.根据图象,温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零;
D.脱除SO2过程反应不易进行,转化率较低,后续步骤碱吸收可以有效脱硫;
③其它条件不变,每次向容积为2L的反应器中充入含2.0mol NO、2.0mol SO2的模拟烟气和4.0mol O3,反应Ⅰ中NO转化率为80%,反应的NO为1.6mol,反应的O3为1.6mol;反应Ⅱ中SO2的转化率30%,反应的二氧化硫0.6mol,反应的O3为0.6mol;2O3(g)![]() 3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.4mol,则体系中剩余O3的物质的量=4.0mol-1.6mol-0.6mol-0.4mol=1.4mol;
3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.4mol,则体系中剩余O3的物质的量=4.0mol-1.6mol-0.6mol-0.4mol=1.4mol;
SO2的平均反应速率由公式:反应速率=△c/△t计算。
平衡状态下O2物质的量=1.6mol+0.6mol+0.6mol=2.8mol,O3物质的量1.4mol,NO剩余物质的量=2mol-1.6mol=0.4mol,过程中生成NO2物质的量1.6mol,据此计算平衡常数。
(1)已知S和CO的燃烧热分别是296.0 kJ·mol1 、283.0 kJ·mol1,热化学方程式为:
①S(s)+O2(g)═SO2(g)△H1=-296.0kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g)△H2=-283.0kJ·mol-1
盖斯定律计算②×2-①得到:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-270 kJ·mol-1;
(2)①反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,相同温度下NO的转化率远高于SO2的原因是:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②A.图象为反应相同时间t后的转化率,反应经历时间t后,并不一定达到化学平衡,所以Q点不一定为平衡点,故A错误;
B.其它条件不变,若扩大反应器的容积,相当于对反应减压,考虑到O3的分解反应,利于臭氧分解为O2,O3浓度减小,不利于反应正向进行,所以不能提高NO和SO2的转化率,故B错误;
C.根据图象,温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零,故C正确;
D.脱除SO2过程反应不易进行,转化率较低,后续步骤碱吸收可以有效脱硫,故D正确,
故答案为:CD;
③其它条件不变,每次向容积为2L的反应器中充入含2.0mol NO、2.0mol SO2的模拟烟气和4.0mol O3,反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g)△H1=-200.9kJ·mol-1 Ea1=3.2kJ·mol-1,反应中NO转化率为80%,反应的NO为1.6mol,反应的O3为1.6mol;反应Ⅱ:SO2(g)+O3(g)
NO2(g)+O2(g)△H1=-200.9kJ·mol-1 Ea1=3.2kJ·mol-1,反应中NO转化率为80%,反应的NO为1.6mol,反应的O3为1.6mol;反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1,反应中SO2的转化率30%,反应的二氧化硫0.6mol,反应的O3为0.6mol;2O3(g)
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1,反应中SO2的转化率30%,反应的二氧化硫0.6mol,反应的O3为0.6mol;2O3(g)![]() 3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.4mol,则体系中剩余O3的物质的量=4.0mol-1.6mol-0.6mol-0.4mol=1.4ol,
3O2(g),发生分解反应的臭氧占充入臭氧总量的10%,为0.4mol,则体系中剩余O3的物质的量=4.0mol-1.6mol-0.6mol-0.4mol=1.4ol,
SO2的平均反应速率=△c/△t=0.6mol/(2L×5min)=0.06mol/(L·min),
平衡状态下O2物质的量=1.6mol+0.6mol+0.6mol=2.8mol,O3物质的量1.4mol,NO剩余物质的量=2mol-1.6mol=0.4mol,过程中生成NO2物质的量1.6mol,据此计算平衡常数,NO(g)+O3(g )![]() NO2(g)+O2(g),平衡常数K=
NO2(g)+O2(g),平衡常数K=![]() =8。
=8。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH=________(填“<”、“>”或“=”)0。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________。
(3)判断该反应是否达到平衡的依据为________。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时,反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。





