题目内容
①将0.100L 1.00mol?L-1的纯碱溶液逐滴滴入0.100L 1.25mol?L-1的盐酸中;
②将0.100L 1.25mol?L-1的盐酸逐滴滴入0.100L 1.00mol?L-1的纯碱溶液中,
两种操作产生CO2的体积比为( )
②将0.100L 1.25mol?L-1的盐酸逐滴滴入0.100L 1.00mol?L-1的纯碱溶液中,
两种操作产生CO2的体积比为( )
分析:n(HCl)=0.100L×1.25mol?L-1=0.125mol,n(Na2CO3)=0.100 L×1.00 mol?L-1=0.100 mol,
将纯碱滴入盐酸中发生的反应为Na2CO3+2HCl═2NaCl+CO2↑+H2O,生成的CO2与盐酸用量有关;
将盐酸滴入纯碱中发生的反应为Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,据此分析解答.
将纯碱滴入盐酸中发生的反应为Na2CO3+2HCl═2NaCl+CO2↑+H2O,生成的CO2与盐酸用量有关;
将盐酸滴入纯碱中发生的反应为Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,据此分析解答.
解答:解:纯碱与盐酸反应时,操作顺序不同反应进程也不同,
操作①:纯碱滴入盐酸中,发生反应:
Na2CO3+2HCl═2NaCl+CO2↑+H2O
生成的CO2与盐酸用量有关:
n(CO2)=
n(HCl)=
×0.100 L×1.25 mol?L-1=0.0625 mol
操作②:盐酸滴入纯碱中,发生反应:
Na2CO3+HCl═NaCl+NaHCO3(1)
NaHCO3+HCl═NaCl+CO2↑+H2O(2)
则反应(1)消耗盐酸:0.100 L×1.00 mol?L-1=0.100 mol,
生成0.100 mol NaHCO3,过量盐酸(0.025 0 mol)与NaHCO3反应生成0.025 0 mol CO2,所以:
n(CO2)①:n(CO2)②=0.0625:0.0250=5:2,
故选A.
操作①:纯碱滴入盐酸中,发生反应:
Na2CO3+2HCl═2NaCl+CO2↑+H2O
生成的CO2与盐酸用量有关:
n(CO2)=
| 1 |
| 2 |
| 1 |
| 2 |
操作②:盐酸滴入纯碱中,发生反应:
Na2CO3+HCl═NaCl+NaHCO3(1)
NaHCO3+HCl═NaCl+CO2↑+H2O(2)
则反应(1)消耗盐酸:0.100 L×1.00 mol?L-1=0.100 mol,
生成0.100 mol NaHCO3,过量盐酸(0.025 0 mol)与NaHCO3反应生成0.025 0 mol CO2,所以:
n(CO2)①:n(CO2)②=0.0625:0.0250=5:2,
故选A.
点评:本题以物质间的反应为载体考查了物质的量的有关计算,注意滴入药品顺序不同发生的反应不同,结合反应方程式分析解答,难度中等.

练习册系列答案
相关题目

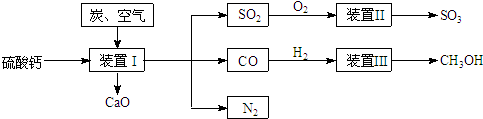

 4)将________。
4)将________。