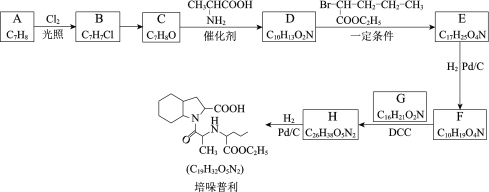
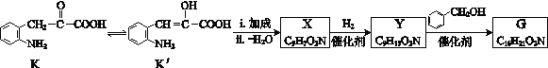题目内容
【题目】下表为元素周期表的一部分,列出8种元素在周期表中的位置。用化学用语回答下列问题:

⑴8种元素中,原子半径最小的是____,原子半径最大的是____,组成物质性质最稳定的是_____。
⑵由⑤组成的单质存在同素异形现象,所组成的同素异形体有:_________;
⑶⑥、⑦两种元素最高价氧化物对应的水化物中,碱性由强到弱的的是__________。
⑷元素⑧的氢化物的化学式为__________。该氢化物的主要用途:用作试剂、航空燃料。写出该氢化物在空气中燃烧的化学方程式为____________。
【答案】H Na He O2 、O3 NaOH Mg(OH)2 SiH4 SiH4+2O2 ![]() SiO2+2H2O
SiO2+2H2O
【解析】
由元素在周期表中位置,可知①为H、②为He、③为C、④为N、⑤为O、⑥为Na、⑦为Mg、⑧为Si,
(1)原子中电子层数越少则半径越小,反之越大,电子层数相同时,原子序数越大半径越小,所有元素中稀有气体化学性质最稳定;
(2)同种元素组成的不同单质为同素异形体;
(3)同周期自左而右金属性减弱,金属性越强最高价氧化物对应水化物的碱性越强;
(4)元素⑧的氢化物为SiH4;在空气中燃烧的方程式为SiH4+2O2 ![]() SiO2+2H2O。
SiO2+2H2O。
由元素在周期表中位置,可知①为H、②为He、③为C、④为N、⑤为O、⑥为Na、⑦为Mg、⑧为Si,
(1)原子半径最小的是H,原子半径最大的是Na,组成物质性质最稳定的是He;
(2)氧元素所组成的同素异形体有O2 、O3;
(3)⑥、⑦两种元素最高价氧化物对应的水化物分别为NaOH、Mg(OH)2,其碱性由强到弱的的是NaOH>Mg(OH)2;
(5)元素⑧的氢化物的化学式为SiH4;在空气中燃烧的方程式为SiH4+2O2 ![]() SiO2+2H2O;
SiO2+2H2O;
故答案为:H;Na;He;O2 、O3;NaOH Mg(OH)2;SiH4;SiH4+2O2 ![]() SiO2+2H2O。
SiO2+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案