题目内容
Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
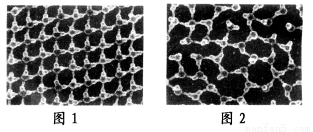
(1)请根据XeF4的结构示意图(图1)判断这个分子是极性分子还是非极性分子?____________________。
(2)XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?__________________。

Ⅱ.已知有关物质的熔、沸点数据如下表:
物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
熔点/℃ | 2 852 | 2 072 | 714 | 190(2.6×105Pa) |
沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,用电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
___________________________________________________________________________________________________________________________________。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是___________________________________________________________________________________________________________________________________。
Ⅰ.(1)非极性分子 (2)分子晶体
Ⅱ.(1)因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,消耗更多的能量,因而不用电解MgO的方法生产镁。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,不存在离子,熔融时不能导电,不能被电解,因而不能用电解AlCl3的方法生产铝
(2)将两种晶体加热到熔融状态,MgCl2能导电,AlCl3不能导电。证明MgCl2为离子晶体,AlCl3为分子晶体
【解析】Ⅰ.(1)由图1可看出该结构为高度对称,故为非极性分子。
(2)因Xe、F都为非金属元素,且结合图2结构图得为分子晶体。
Ⅱ.(1)因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,消耗更多的能量,因而不用电解MgO的方法生产镁。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,不存在离子,熔融时不能导电,不能被电解,因而不能用电解AlCl3的方法生产铝
(2)区别离子晶体和分子晶体就看两晶体在熔融状态下能否导电,若能导电,则为离子晶体;若不导电,则为分子晶体。

 通城学典默写能手系列答案
通城学典默写能手系列答案相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1
2XY3(g) ΔH=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热:23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
下列叙述不正确的是( )
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①的体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
用一带静电的玻璃棒靠近A、B两种纯液体流,根据图分析,这两种液体分子的极性正确的是( )。

A.A是极性分子,B是非极性分子
B.A是非极性分子,B是极性分子
C.A和B都是极性分子
D.A和B都是非极性分子
NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )。
物质 | ①NaF | ②NaI | ③MgO |
离子电荷数 | 1 | 1 | 2 |
离子间距离/10-10 m | 2.31 | 3.18 | 2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③