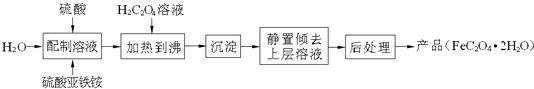
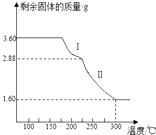
题目内容
【题目】如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去.常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀. 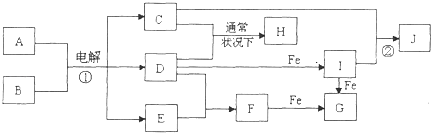
(1)H的化学式为 .
(2)F的电子式为 .
(3)反应①的化学方程式为 .
(4)反应②的离子方程式为 .
【答案】
(1)NaClO
(2)![]()
(3)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(4)Fe3++3OH﹣=Fe(OH)3↓
【解析】解:F的水溶液是盐酸,则F为HCl,D是黄绿色气体,为Cl2 , 与无色气体E反应得到F,可推知E为H2 , A、C的焰色反应都呈黄色,均含有Na元素,化合物A是家庭生活中常用的一种调味品,B是无色无味的液体,反应①应是电解饱和的食盐水,A为NaCl、B为H2O,C为NaOH,H的水溶液具有漂白、杀菌性,由D于C反应得到,故H为NaClO,F(HCl)与Fe反应生成G为FeCl2 , 氯气与Fe反应生成I为FeCl3 , 与C(NaOH)反应生成红褐色沉淀J为Fe(OH)3 , (1)由上述分析可知,H的化学式为NaClO,所以答案是:NaClO;(2)F为HCl,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)反应①的化学方程式为:2NaCl+2H2O
;(3)反应①的化学方程式为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;(4)反应②的离子方程式为:Fe3++3OH﹣=Fe(OH)3↓,所以答案是:Fe3++3OH﹣=Fe(OH)3↓.
2NaOH+Cl2↑+H2↑;(4)反应②的离子方程式为:Fe3++3OH﹣=Fe(OH)3↓,所以答案是:Fe3++3OH﹣=Fe(OH)3↓.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.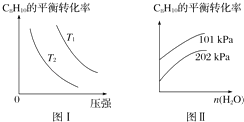
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .