题目内容
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
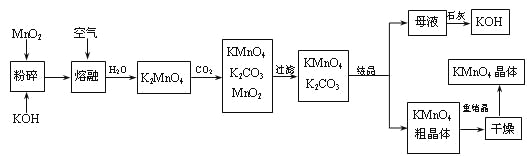
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
【答案】BD 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O K2MnO4 MnO2 KOH 2/3
2K2MnO4+2H2O K2MnO4 MnO2 KOH 2/3
【解析】
(1)KMnO4有强氧化性,消毒原理与84消毒液、双氧水一样;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,根据守恒法配平;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,所含元素化合价升高的反应物是还原剂;
(4)制备中利用的原料,在转化过程中又生成的可以循环利用;
(5)根据反应的方程式判断。
(1)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选:BD;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂。
(4)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用。
(5)2MnO2+4KOH+O2![]() 2K2MnO4+2H2O可知最初的原料中1mol MnO2恰好得到1mol K2MnO4。由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到2/3molKMnO4。
2K2MnO4+2H2O可知最初的原料中1mol MnO2恰好得到1mol K2MnO4。由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到2/3molKMnO4。

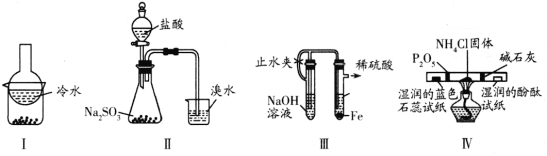
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
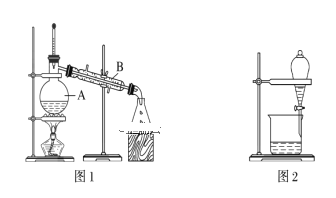
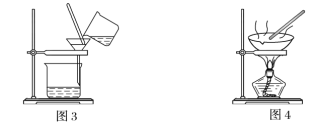
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是_______________________。下列关于以上实验操作说法一定正确的是_____。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。已知:Zn+2H2SO4(浓)![]() ZnSO4+2H2O+SO2↑。现有甲乙两研究小组分别实验探究:
ZnSO4+2H2O+SO2↑。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解。
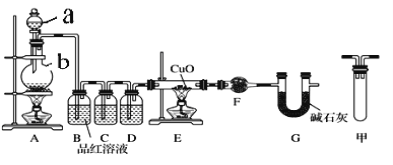
①填写仪器名称:a___________、b___________。
②研究小组认为还可能产生氢气的理由是:_____________________。
③装置D中加入的试剂是__________。
④U型管G的作用为__________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是______________________________。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是________。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是______。