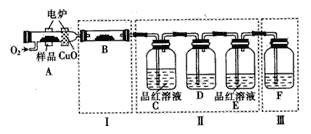
题目内容
【题目】氧化铁和铁粉的混合物19.2 g,恰好溶于150 mL某浓度的稀硫酸,并收集到3.36 L(标准状况下)的气体.向反应后的溶液中滴加硫氰化钾溶液,不显血红色.求:
(1)与稀硫酸反应的铁的物质的量.___________
(2)稀硫酸的物质的量浓度._____________
【答案】0.15 mol 2mol /L
【解析】
根据Fe2O3、Fe的混合物与硫酸恰好完全反应生成了铁的硫酸盐,反应后反应加入KSCN溶液,无血红色出现,说明只生成FeSO4,,发生反应为:Fe+H2SO4=FeSO4+H2↑、Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,根据生成的氢气计算与硫酸反应的Fe的质量,进而计算与硫酸反应的Fe、Fe2O3的质量,再计算混合物中Fe的质量,根据守恒可以知道原硫酸溶液中n(H2SO4)=n(FeSO4),再根据c=n/V计算。
(1)Fe、Fe2O3的混合物与硫酸恰好完全反应,生成了铁的硫酸盐,反应后反应加入KSCN溶液,无血红色出现,说明只生成FeSO4,发生反应为:Fe+H2SO4=FeSO4+H2↑、Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,n(H2)=![]() =0.15mol,则:
=0.15mol,则:
Fe+H2SO4=FeSO4+H2↑
1 1
n(Fe) 0.15mol,
n(Fe)=0.15mol,所以答案为:0.15mol;
(2)根据上述分析可知 m(Fe)=0.15mol![]() 56g/mol=8.4g,故与硫酸反应的Fe2O3和Fe的质量为19.2g-8.4g=10.8g,由Fe+Fe2O3+3H2SO4=3FeSO4+3H2O可知,消耗硫酸的量为0.15mol,生成FeSO4为0.15mol,溶液中总的FeSO4为0.15mol+0.15mol=0.3mol,故根据守恒可以知道原硫酸溶液中n(H2SO4)=n(FeSO4)=0.3mol,原硫酸溶液的物质的量浓度为c =
56g/mol=8.4g,故与硫酸反应的Fe2O3和Fe的质量为19.2g-8.4g=10.8g,由Fe+Fe2O3+3H2SO4=3FeSO4+3H2O可知,消耗硫酸的量为0.15mol,生成FeSO4为0.15mol,溶液中总的FeSO4为0.15mol+0.15mol=0.3mol,故根据守恒可以知道原硫酸溶液中n(H2SO4)=n(FeSO4)=0.3mol,原硫酸溶液的物质的量浓度为c = ![]() =2mol/L;答案:2mol/L。
=2mol/L;答案:2mol/L。

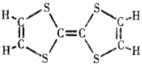
【题目】Ⅰ.某一溴代烷与浓NaOH的醇溶液共热时产生3种沸点不同的消去产物,该一溴代烷至少应含有________个碳原子,其中一种结构简式可表示为____________。
Ⅱ.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”);
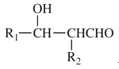
Ⅲ.有机物A分子式为C3H6O2,把它进行实验并记录现象如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
A | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
A的结构简式为:_____________