题目内容
13.现有铁的氧化物16g,用足量CO还原后,将产生的CO2全部用澄清石灰水吸收,得到沉淀30g.问铁的氧化物可能是什么?(提示:可以用关系式法,设铁的氧化物化学式为FexOy,写出两个方程式,找出FexOy与CaCO3间的关系,再计算x与y的比值)分析 反应中CO转化为CO2,则n(CO)=n(CO2)=n铁氧化物(O),产生的CO2全部用澄清石灰水吸收,得到沉淀30g为CaCO3,根据碳元素守恒n(CO2)=n(CaCO3),计算Fe的氧化物中Fe元素质量,进而计算Fe原子物质的量确定氧化物化学式.
解答 解:产生的CO2全部用澄清石灰水吸收,得到沉淀30g为CaCO3,根据碳元素守恒n(CO2)=n(CaCO3)=$\frac{30g}{100g/mol}$=0.3mol,反应中CO转化为CO2,则n铁氧化物(O)=n(CO)=n(CO2)=0.3mol,故Fe的氧化物中Fe元素质量=16g-0.3mol×16g/mol=11.2g,故Fe原子物质的量为$\frac{11.2g}{56g/mol}$=0.2mol,则氧化物中Fe、O原子数目之比为0.2mol:0.3mol=2:3,故该铁的氧化物为Fe2O3,
答:该铁的氧化物为Fe2O3.
点评 本题考查化学方程式有关计算,明确反应过程是解题关键,注意利用守恒法进行解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列能使湿润的红色石蕊试纸变蓝的气体是( )
| A. | N2 | B. | NH3 | C. | HCl | D. | SO2 |
4.下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合初中化学和生物学科的知识,回答下列问题.
(1)碘是合成下列哪种激素的主要原料之一B
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患C
A.甲状腺亢进 B.贫血症 C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是元素(填元素、原子或单质).
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
(6)已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3-+5I-+6H+═3I2+3H2O).现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质①③④(填序号).
| 配料表 | 精制海盐、碘酸钾[ |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患C
A.甲状腺亢进 B.贫血症 C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是元素(填元素、原子或单质).
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
(6)已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3-+5I-+6H+═3I2+3H2O).现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质①③④(填序号).
1.芳香族化合物X的结构如图所示,下列叙述不正确的是( )


| A. | X分子中最多可有9个碳原子共平面 | |
| B. | X可以发生取代、加成、聚合等反应 | |
| C. | 1 mol X与足量NaHCO3溶液反应所得物质的分子式为C9H7O4Na | |
| D. | 苯环上的取代基与X完全相同的X的同分异构体有4种 |
8.下列表述正确的是( )
| A. | 某离子第三层上和第二层上的电子数均为第一层的4倍 | |
| B. | Cl-的结构示意图: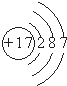 | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C和14N的质量数相等,互称为同位素 |
18.将一定质量的Al、Fe混合物加人到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如果将等质量的该混合物加入到足量的Na0H溶液中,充分反应后得到标准状况下的氢气6.72L.下列关于该混合物的说法正确的是( )
| A. | Fe的质量为2.7g,Al的质量为2.8g | B. | Fe的质量为2.8g,Al的质量为2.7g | ||
| C. | Fe的质量为5.4g,Al的质量为5.6g | D. | Fe的质量为5.6g,Al的质量为5.4g |
20.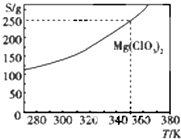 Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
 Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ | |
| D. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% |
1.已知常温下在溶液中可发生如下两个离子反应:
①Ge4++Fe2+═Fe3++Ge3+
②Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
①Ge4++Fe2+═Fe3++Ge3+
②Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
| A. | Sn2+、Fe2+、Ge3+ | B. | Sn2+、Ge3+、Fe2+ | C. | Ge3+、Fe2+、Sn2+ | D. | Fe2+、Sn2+、Ge3+ |