题目内容
【题目】2019年12月20日,美国总统特朗普签署了2020财政年度国防授权法案,对俄罗斯向欧洲进行天然气输出的“北溪2号”管道项目实施制裁,实施“美国优先发展战略”。天然气既是一种优质能源,又是一种重要化工原料,甲烧水蒸气催化重整制备高纯氢是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.![]()
Ⅱ.![]()
根据上述信息请写出甲烷水蒸气催化重整的热化学反方程式:________________。
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入![]() 和
和![]() ,利用反应Ⅰ制备
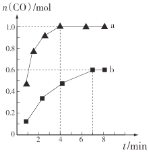
,利用反应Ⅰ制备![]() ,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
则a、b两容器的温度________(填“相同”“不相同”或“不确定”);在达到平衡前,容器a的压强________(填“逐渐增大”“不变”或“逐渐减小”);容器a中![]() 从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中![]() 参与电极反应。工作时负极的电极反应为
参与电极反应。工作时负极的电极反应为![]() 。如图所示,根据相关信息回答下列问题:
。如图所示,根据相关信息回答下列问题:
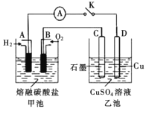
①正极的电极反应为________;
②当甲池中A电极理论上消耗![]() 的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
【答案】![]() 不相同 逐渐增大
不相同 逐渐增大 ![]() 675
675 ![]() 1.28
1.28
【解析】
(1)根据盖斯定律进行计算得到甲烷水蒸气催化重整的热化学反方程式。
(2)先计算甲烷消耗得物质的量,再算其平均反应速率,再计算甲烷、水剩余的物质的量,CO物质的量,H2物质的量,再计算反应的化学平衡常数。
(3)①正极是氧气变为碳酸根;②根据得失电子守恒建立关系进行计算。
(1)将两个方程式相加得到甲烷水蒸气催化重整的热化学反方程式:![]() ;故答案为:
;故答案为:![]() 。
。
(2)a、b两容器达到平衡时CO的物质的量不相同,由于容器体积相同,因此反应的温度不相同;在达到平衡前,反应是气体物质的量增加的反应,因此容器a的压强逐渐增大;容器a中甲烷从反应开始到恰好平衡时所需时间为4min,甲烷消耗得物质的量为1mol,因此其平均反应速率为![]() ,甲烷、水剩余的物质的量为0.1mol,CO物质的量为1mol,H2物质的量为3mol,在该温度下反应的化学平衡常数
,甲烷、水剩余的物质的量为0.1mol,CO物质的量为1mol,H2物质的量为3mol,在该温度下反应的化学平衡常数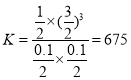 ;故答案为:不相同;逐渐增大;
;故答案为:不相同;逐渐增大;![]() ;675。
;675。
(3)①正极是氧气变为碳酸根,其电极反应为![]() ;故答案为:
;故答案为:![]() 。
。
②当甲池中A电极理论上消耗氢气的体积为448 mL即0.02mol时,转移电子为0.04mol,乙池中C生成氧气,D质量增加,生成0.02mol铜,因此两电极质量变化量之差为0.02×64 g=1.24g;故答案为:1.24。

【题目】比较纯碱的两种工业制法,正确的是
选项 | 项目 | 氨碱法 | 联合制碱法 |
A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
B. | 可能的副产物 | 氯化钙 | 氯化铵 |
C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
A.AB.BC.CD.D
【题目】高炉炼铁过程中发生反应:![]() ,该反应在不同温度下的平衡常数见表。下列说法正确的是( )
,该反应在不同温度下的平衡常数见表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A.平衡后温度不变缩小容器容积,![]() 的转化率升高
的转化率升高
B.增加高炉的高度可以有效降低炼铁尾气中CO的含量
C.其他条件不变时,增大c(CO),该反应的K值增大
D.由表中数据可判断该反应:反应物总能量大于生成物的总能量
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p |
(1)在周期表中,与元素b的化学性质最相似的邻族元素是________(填写以上表中字母对应的元素符号),该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。
(2)元素As与________同族(填写以上表中字母对应的元素符号),其简单气态氢化物的稳定性由大到小的顺序是________。
(3)基态ρ原子成为阳离子时首先失去________轨道电子,基态![]() 的最外层电子排布式________。
的最外层电子排布式________。
(4)i的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式为________________。
(5)下列关于上图表中元素说法正确的是________(填序号)。
①未成对电子数最多的元素是O
②元素的电负性强弱;![]()
③元素的第一电离能:![]()
④简单离子半径:![]()
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用铂丝蘸取少量NaCl溶液进行焰色反应,火焰呈黄色 | 这是钠离子的发射光谱 |
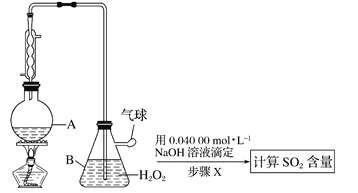
C | NaI溶液 | 酸性条件下H2O2的氧化性比I2强 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D