题目内容
某温度下在2L密闭容器中,反应2SO2+O2 2SO3进行一段时间后SO3的物质的量增加了0.4mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·s-1,则这段时间为
2SO3进行一段时间后SO3的物质的量增加了0.4mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·s-1,则这段时间为
 2SO3进行一段时间后SO3的物质的量增加了0.4mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·s-1,则这段时间为
2SO3进行一段时间后SO3的物质的量增加了0.4mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·s-1,则这段时间为[ ]
A.0.1s
B.0.25s
C.0.5s
D.2.5s
B.0.25s
C.0.5s
D.2.5s
B

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
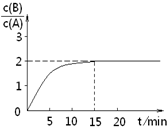 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1
反应过程中时间t与A、B浓度有如图关系,若测得第15min时
c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |
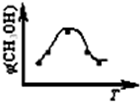 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.