题目内容
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
| 阳离子 | NH4+、 Na+、 Mg2+ |
| 阴离子 | OH-、 NO3-、 SO42- |
若取等质量的甲、乙、丙配制成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),则乙物质
A.可能是NaOH B.可能是NH4NO3
C.不可能有SO42- D.一定不是(NH4)2SO4
B
解析试题分析:等质量的甲、乙、丙配制成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),说明其摩尔质量的关系为c(甲)<c(乙)<c(丙),由于是可溶性强电解质,组成情况按照相对分子质量排序为NaOH,NH4NO3,MgSO4,或为NaOH,Mg(NO3)2,(NH4)2SO4,故乙物质可能是NH4NO3。
考点:本题考查了离子的共存及物质的组成分析。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
下列离子方程式正确的是( )
| A.乙酸与碳酸钠溶液反应:2H++CO32-== CO2↑+H2O |
| B.澄清石灰水中加入过量的碳酸氢钠溶液:Ca2+ + HCO + OH-= CaCO3↓ + H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O 2C6H5OH+CO32- 2C6H5OH+CO32- |
D.甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH- CO32-+2NH4++ 4Ag↓+ 6NH3↑+ 2H2O 。 CO32-+2NH4++ 4Ag↓+ 6NH3↑+ 2H2O 。 |
将以下4份溶液分别置于下图的装置中,其它条件相同时,灯泡最亮的是
| A.100mL 1mol/L的盐酸 |
| B.100mL 2mol/L的蔗糖溶液 |
| C.100mL 1mol/L的醋酸溶液 |
| D.30mL 1mol/L的CaCl2溶液 |
下列实验过程中产生的现象与所给图形相符合的是( )
| A.往乙酸中通入氨气 |
B.往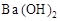 溶液中滴加硫酸 溶液中滴加硫酸 |
| C.往氢硫酸溶液中通入氯气 |
| D.往NaOH溶液中通入过量CO2 |
下列离子反应方程式正确的是 ( )
A.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42- Cu2++ SO2↑+ 2H2O Cu2++ SO2↑+ 2H2O |
B.电解饱和食盐水:2Cl- +2H+ H2↑+C12↑ H2↑+C12↑ |
| C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+ |
| D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
某溶液仅含Fe2+、Na+、Al3+、Ba2-、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
| A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为7.2克 |
| B.若向该溶液中加入足量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.若向该溶液中加入足量的稀硫酸和KSCN溶液,溶液显血红色 |
| D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
下列表示对应化学反应的离子方程式正确的是
| A.Ca(HCO3)2溶液与少量NaOH溶液反应: 2HCO3-+Ca2++2OH-=CaCO3↓+2H2O + CO32- |
| B.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| D.NaHCO3溶液与稀HCl反应:HCO3-+H+=H2O+CO2↑ |
下列电离或离子方程式正确的是
A.亚硫酸的电离:H2SO3 2H++ SO3 2H++ SO3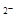 |
B.氯化铵水解的离子方程式为:NH4+ +H2O  NH3·H2O + H+ NH3·H2O + H+ |
C.NaHCO3水解的离子方程式为:HCO3-+H2O CO3 CO3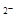 +H3O+ +H3O+ |
D.向氯化铝溶液中加入过量的氨水:A1 +3NH3·H2O= Al(OH)3↓+3NH4+ +3NH3·H2O= Al(OH)3↓+3NH4+ |