题目内容
16.下列说法正确的是( )| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 加热、强酸、强碱、重金属盐、乙醇等均可使蛋白质变性 | |
| C. | 酶具有很强的催化作用,胃蛋白酶只能催化蛋白质的水解,348K时活性更强 | |
| D. | 为检验皂化反应进行程度,取几滴反应液,滴入装存热水的试管中,振荡,若有油滴浮在液面上,说明油脂已完全反应 |
分析 A.葡萄糖为单糖,不能发生水解反应;
B.强酸、强碱、加热及某些有机物可使蛋白质发生变性;
C.酶有催化作用,酶的催化作用具有专一性,在30-50℃时酶的活性最强;
D.若有油滴浮在液面上,可知还有油脂.
解答 解:A.葡萄糖为单糖,不能发生水解反应,而纤维素、蔗糖、脂肪在一定条件下都可发生水解反应,故A错误;
B.强酸、强碱、加热及某些有机物可使蛋白质发生变性,变性为不可逆反应,故B正确;
C.酶具有很强的催化作用,胃蛋白酶能催化蛋白质的水解,酶具有专一性,348K时的温度是75度,75度的高温有可能使酶失活,故C错误;
D.振荡,若有油滴浮在液面上,油脂没有完全水解,且碱性条件下完全水解后溶液不分层,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6. 用浓度为0.5mol•L-1的NaOH溶液滴定50mL 0.01mol•L-1Al2(SO4)3溶液,测得导电能力随加入溶液的体积变化曲线如图所示.下列说法中正确的是( )
用浓度为0.5mol•L-1的NaOH溶液滴定50mL 0.01mol•L-1Al2(SO4)3溶液,测得导电能力随加入溶液的体积变化曲线如图所示.下列说法中正确的是( )
 用浓度为0.5mol•L-1的NaOH溶液滴定50mL 0.01mol•L-1Al2(SO4)3溶液,测得导电能力随加入溶液的体积变化曲线如图所示.下列说法中正确的是( )
用浓度为0.5mol•L-1的NaOH溶液滴定50mL 0.01mol•L-1Al2(SO4)3溶液,测得导电能力随加入溶液的体积变化曲线如图所示.下列说法中正确的是( )| A. | a点溶液中离子浓度存在关系:c(Al3+)+c(H+)═c(SO42-)+c(OH-) | |
| B. | b点溶液中有:c(Na+)═c(SO42-) | |
| C. | c点对应的溶液显酸性 | |
| D. | 滴定过程中始终存在:c(SO42-)>c(AlO2-) |
4.下列说法正确的是( )
| A. | 石油的催化裂化可得到较多的轻质油 | |
| B. | “西气东输”中输送的气体主要是乙烯 | |
| C. | 煤间接液化的主要目的是获得各种芳香烃 | |
| D. | 石油通过常压分馏可以得到石蜡等相对分子质量较大的烷烃 |
11.下列有机物能使酸性KMnO4溶液褪色的是( )
①CH3CH2CH3 ② ③CH3CH2CH2Br
③CH3CH2CH2Br
④CH3CH2CH2OH ⑤CH3CH2CHO ⑥HCOOCH2CH3.
①CH3CH2CH3 ②
 ③CH3CH2CH2Br
③CH3CH2CH2Br④CH3CH2CH2OH ⑤CH3CH2CHO ⑥HCOOCH2CH3.
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ④⑤⑥ |
1.分子式为C8H8O2的芳香族化合物能发生银镜反应,其中含有一个甲基的同分异构体共有(不考虑立体异构)( )
| A. | 10种 | B. | 13种 | C. | 16种 | D. | 22种 |
8.将铁片和碳棒用导线连接后放入稀盐酸中,发生原电池反应,下列叙述错误的是( )
| A. | 溶液的H+浓度减小 | B. | 溶液中的Fe2+浓度增大 | ||
| C. | 溶液中的Cl-浓度增大 | D. | 溶液的密度增大 |
6.H2S在金属离子的鉴定分析、煤化工等领域都有重要应用.请回答:
Ⅰ、工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物.
(1)该反应的化学方程式为4SO2+3CH4═4H2S+3CO2+2H2O.
II.H2S可用于检测和沉淀金属阳离子.
(2)H2S的第一步电离方程式为H2S?H++HS-.
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1mol•L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=8.0×10-3mol/L(溶液体积变化忽略不计).
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
ⅰ.COS(g)+H2(g)?H2S(g)+CO(g)△H=+7kJ•mol-1;
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42kJ•mol-1;
(4)己知:断裂1mol分子中的化学键所需吸收的能量如下表所示.
表中x=1076.
(5)向10L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应.其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示.

①随着温度升高,CO的平衡体积分数增大(填“增大”或“减小”),原因为反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大.
②T1℃时,测得平衡时体系中COS的物质的童为0.80mol.则该温度下,COS的平衡转化率为20%;反应i的平衡常数为0.044(保留两位有效数字).
Ⅰ、工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物.
(1)该反应的化学方程式为4SO2+3CH4═4H2S+3CO2+2H2O.
II.H2S可用于检测和沉淀金属阳离子.
(2)H2S的第一步电离方程式为H2S?H++HS-.
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1mol•L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=8.0×10-3mol/L(溶液体积变化忽略不计).
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
ⅰ.COS(g)+H2(g)?H2S(g)+CO(g)△H=+7kJ•mol-1;
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42kJ•mol-1;
(4)己知:断裂1mol分子中的化学键所需吸收的能量如下表所示.
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ•mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
(5)向10L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应.其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示.

①随着温度升高,CO的平衡体积分数增大(填“增大”或“减小”),原因为反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大.
②T1℃时,测得平衡时体系中COS的物质的童为0.80mol.则该温度下,COS的平衡转化率为20%;反应i的平衡常数为0.044(保留两位有效数字).
 +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$

 的化学反应方程式
的化学反应方程式 、
、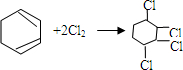 .
.