题目内容
18.A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A与C、B与 D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18 个电子.请回答下列问题:(1)A元素单质的化学式为H2,D元素的离子结构示意图为
 .
.(2)写出C、D、E最高价氧化物对应水化物的化学式NaOH、H2SO4、HClO4(用化学式表示)
(3)由B元素形成的单质的结构式可表示为O=O.
(4)由A、B、C三种元素形成的化合物的电子式为
 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.(5)比较D、E的气态氢化物与HF的稳定性的由强到弱的顺序为HF>HCl>H2S(用化学式表示)
分析 A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,则A为H元素;A与E形成的化合物化学式为AE,其分子中含18个电子,则E原子含有17个电子,故E为氯元素;A与C同主族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,B与D分别为同主族,原子序数B小于D,则B为O元素,D为S元素;C原子序数大于氧元素,C与氢元素为同主族,故C为Na元素,据此解答.
解答 解:A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,则A为H元素;A与E形成的化合物化学式为AE,其分子中含18个电子,则E原子含有17个电子,故E为氯元素;A与C同主族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,B与D分别为同主族,原子序数B小于D,则B为O元素,D为S元素;C原子序数大于氧元素,C与氢元素为同主族,故C为Na元素.
(1)A为H元素,单质的化学式为H2,D为S元素,S2-离子结构示意图为 ,
,
故答案为:H2; ;
;
(2)Na、S、Cl最高价氧化物对应水化物的化学式分别为:NaOH、H2SO4、HClO4,
故答案为:NaOH、H2SO4、HClO4;
(3)由B元素形成的单质为O2,分子中O原子之间形成2对共用电子对,其结构式可为O=O,
故答案为:O=O;
(4)由A、B、C三种元素形成的化合物为NaOH,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为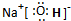 .晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,
.晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,
故答案为: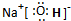 ;离子键、共价键;
;离子键、共价键;
(5)非金属性F>Cl>S,故氢化物稳定性:HF>HCl>H2S,
故答案为:HF>HCl>H2S.
点评 本题考查结构位置关系、元素周期律、常用化学用语、化学键等,难度不大,推断元素是解题的关键.

| A. | $\frac{a}{A(A-N+m)mol}$ | B. | $\frac{a}{A}$(A-N) mol | C. | $\frac{a}{A+m}$(A-N) mol | D. | $\frac{a}{A+m}$(A-N+m) mol |
| A. | H2O的沸点比较高,是由于水分子间存在氢键的原因 | |
| B. | 除稀有气体外的非金属元素都能生成不同价态的含氧酸 | |
| C. | 若ⅡA族某元素的原子序数为m,则同周期ⅢA族元素的原子序数可能为m+11 | |
| D. | 由于分子间作用力比化学键弱得多,所以干冰升华容易,而CO2气体分解却不易 |
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
| A. | 少量铁粉加入AgNO3溶液中 | |
| B. | 少量Na2O2粉末加入CuSO4溶液中 | |
| C. | 少量BaSO4粉末加入饱和Na2CO3溶液中 | |
| D. | 少量Al2(SO4)3粉末加入Ba(OH)2溶液中 |