题目内容
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为:________________ __,漂白粉的有效成分为 。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2mol·L-1NaOH溶液、2mol·L-1HCl溶液、2mol·L-1HNO3溶液、0.5mol·L-1BaCl2溶液、0.01mol·L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 | |
| 步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入 | 现象: 结论: |
| 步骤3:取滤液分装A、B两支试管。向A试管, | 现象:溶液先变红色,然后褪色。 结论: |
| 步骤4:向B试管, | 现象:产生白色沉淀。 结论: |
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00mL。则该漂白粉中Ca(ClO)2的质量分数为_____________ _。(只列算式,不做运算,已知:Mr[Ca(ClO)2]="143" ;Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
(17分)
(1)2Ca(OH)2+2Cl2=CaCl2+ Ca(ClO)2+2H2O (3分) Ca(ClO)2(1分)
(2)实验步骤 预期现象与结论
步骤2:适量澄清石灰水(1分)现象:沉淀溶解(1分),产生的气体使石灰水变浑浊(产生沉淀),或石灰水先产生白色沉淀,后沉淀溶解)(1分)
结论:该漂白粉含有CaCO3。(1分)
步骤3:滴加2滴酚酞试液(1分) 结论:该漂白粉含有Ca(ClO)2,(1分)
可能含有Ca(OH)2。(1分)步骤4:滴加过量2mol·L-1HNO3溶液(1分)和0.01mol·L-1AgNO3溶液(1分)
结论:该漂白粉含有CaCl2。(1分)
(说明:1、试剂用量不准确,整题合扣1分; 2、其他合理即给分)
(3) 或
或 
或 (3分,有效数字不准确,扣1分)
(3分,有效数字不准确,扣1分)
解析试题分析:(1)工业上用氯气和足量氢氧化钙反应制漂白粉,即2Ca(OH)2+2Cl2=CaCl2+ Ca(ClO)2+2H2O;漂白粉的有效成分是次氯酸钙,即Ca(ClO)2;(2)步骤2:若漂白粉变质,由于碳酸的酸性比次氯酸强,则次氯酸钙与空气中的CO2、H2O能发生复分解反应,即Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,因此漂白粉溶于水后所得沉淀可能是碳酸钙;盐酸的酸性比碳酸强,若沉淀溶于足量2mol/LHCl溶液,产生的气体能使足量澄清石灰水变浑浊,或者产生的气体先使澄清石灰水变浑浊,后又变澄清,说明漂白粉已经部分变质或完全变质,其中含有CaCO3;步骤3:酚酞先遇碱性溶液变红,后遇次氯酸盐溶液褪色,根据结论推断,向A管中加入几滴或少量酚酞溶液,振荡,溶液先变红后褪色的,说明该漂白粉部分变质,含有Ca(ClO)2,可能含有Ca(OH)2;步骤4:向B管中先滴入足量2mol/LHNO3溶液、后滴入少量0.01mol/LAgNO3溶液,产生白色沉淀,说明该漂白粉中含有CaCl2;(3)由于n=c?V,则每次滴定平均消耗0.1000×20.00×10—3molNa2S2O3;由于2Na2S2O3+I2=Na2S4O6+2NaI中各物质的系数之比等于物质的量之比,则与Na2S2O3反应的I2为0.1000×20.00×10—3/2mol;由于 Cl2+2KI=2KCl+I2中各物质的系数之比等于物质的量之比,则置换出I2需要0.1000×20.00×10—3/2mol Cl2;由于Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O中各物质的系数之比等于物质的量之比,则25.00mL漂白粉溶液中含有的Ca(ClO)2为0.1000×20.00×10—3/4mol;100mL漂白粉溶液中含有的Ca(ClO)2为0.1000×20.00×10—3/4×100/25.00mol,由于m=n?M、Mr[Ca(ClO)2]=143,则100mL漂白粉溶液中含有的0.1000×20.00×10—3/4×100/25.00×143gCa(ClO)2,则漂白粉中Ca(ClO)2的质量分数为0.1000×20.00×10—3/4×100/25.00×143/b×100%。
考点:考查物质的制备、探究实验、化学计算,涉及漂白粉的制备、设计漂白粉成分探究试验方案、有关漂白粉有效成分质量分数的定量计算。

 期末集结号系列答案
期末集结号系列答案富马酸亚铁(分子式为C4H2O4Fe,结构简式为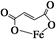 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图: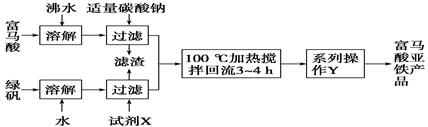
①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ | |
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问。久置KI固体被氧化变质,呈浅黄色(有I2),KI固体直接加热时,为什么不被氧化呢?因此,小组同学针对I-被氧化条件除了氧气之外还需要什么条件进行了实验探究。
【提出假设】根据久置KI固体会被氧化而变质,结合空气的成分,首先排除 和稀有气体的影响。然后对KI变质条件提出合理假设:
假设一:需要H2O的参与;
假设二:需要CO2的参与;
假设三: 。
【实验验证】
(1)为了验证假设二,小组同学设计了以下实验方案;取10mLKI溶液(浓度较大)于5支试管中,向试管中通入CO2气体或者滴加盐酸。一段时间后对比试管中的颜色深浅,之后向试管中滴入淀粉溶液,再次对比试管中的颜色深浅,具体实验现象见下表:
| 试管序号 | 1 | 2 | 3 | 4 | 5 |
| 通入CO2时间/min | 0 | 1 | 5 | | |
| 滴加盐酸/滴 | 0 | | | 3 | 6 |
| 溶液中颜色对比 | 无色 | 浅黄色→黄色(依次加深) | |||
| 滴加淀粉溶液后的颜色对比 | 无色 | 浅蓝色→蓝色(依次加深) | |||
小组同学通过实验现象深入思考了CO2在反应过程中的作用,得出结论:CO2气体同盐酸一样在KI被氧化的过程中提供 环境。
写出此实验中CO2与KI反应的化学方程式 。
(2)为了验证I-被氧化是否必须要有H2O的参与,小组同学设计了以下实验验证:
| 实验步骤 | 预期现象和结论 |
| ①取一份纯净的KI固体,分成两等份; | |
| ②一份加入到装有 的集气瓶A中; 一份加入到装有 的集气瓶A中; ③几天后观察。 | |
【交流提高】
由于空气中CO2和水蒸气的含量很低,导致在加热KI的过程中这两种气体很容易被“驱散”,不能很好地与KI接触,KI自然就不能被氧化。长时间保存碘化钾需要避光、 。
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾[KAl(SO4)2?12H2O]中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由__________________________组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为________,该发酵粉的成分为__________________。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由:________________, ____________________________________________________________________。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/LNaOH溶液,写出实验步骤、预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后, 将溶液分成两份,分别装入A、B试管中。 | |
| 步骤2:_____________________________ __________________________________ | ________________________证明有Na+,发 酵粉中有NaHCO3。 |
| 步骤3:_____________________________ ___________________________________ | ___________________________________ _______,结合步骤2中的结论,假设2成立。 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
| 选项 | a中物质 | b中物质 | c中收集气体 | d中物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | 浓盐酸 | HCl | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |








