题目内容
下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
实验次数 | 称取样品的 质量/g | 所加Ba(OH)2 溶液的体积/L | 测得生成沉淀 的质量/g |
1 | 0.518 | 0.5 | 0.985 |
2 | 1.036 | 0.5 |
|
3 | 1.554 | 0.5 | 2.955 |
4 | 2.072 | 0.5 | 3.940 |
5 | 2.590 | 0.5 | 3.940 |
6 | 3.108 | 0.5 | 3.940 |
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀多少克?请将结果填在表格相应空格中。
(2)样品中KHCO3和Na2CO3的物质的量之比是 。
(3)室温下,取上述Ba(OH)2溶液50 mL,加入0.05 mol·L-1的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程)。
(1)1.970 (2)2∶3
(3)由0.518∶2.072=0.985∶3.940可知第4次实验中反应物恰好完全沉淀,即有:
原0.5 L Ba(OH)2溶液中:n(OH-)=2×(3.940 g÷197 g·mol-1)=0.04 mol,c(OH-)=0.04 mol/0.5 L=0.08 mol·L-1
溶液pH=2,则c(H+)=0.01 mol·L-1
(0.05 mol·L-1×V-0.08 mol·L-1×50 mL)÷(V mL+50 mL)=0.01 mol·L-1
V=112.5 mL
【解析】(1)分析表中数据可知,第2次实验中Ba(OH)2过量,样品完全反应,则有0.518∶1.036=0.985∶x,x=1.970;(2)第1、2、3次实验均为Ba(OH)2过量,选取第1次计算:
设样品混合物中KHCO3和Na2CO3的物质的量分别为x、y,则有:
100 g·mol-1×x+106 g·mol-1×y=0.518 g
x+y=0.985 g÷197 g·mol-1
解方程组得:x=0.002 mol、y=0.003 mol
故KHCO3和Na2CO3的物质的量之比为2∶3

 名校课堂系列答案
名校课堂系列答案大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。

(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HOI(aq) ΔH2
HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为_________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。
(3) 为探究Fe2+对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中I3—浓度和体系pH,结果见下图和下表。
编号 | 反应物 | 反应前pH | 反应后pH |
第1组 | O3+I- | 5.2 | 11.0 |
第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
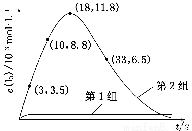
图2
①第1组实验中,导致反应后pH升高的原因是_____________________________
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是_____________________________________________
③第2组实验进行18 s后,I3—浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。










