题目内容
将8.8g FeS固体置于200mL 2.0mol/L的盐酸中,以制备H2S气体.反应完全后,若溶液中H2S的浓度为0.10mol/L,假定溶液体积不变,试计算:
(1)收集到的H2S气体的体积(标准状况).
(2)溶液中Fe2+和H+的物质的量浓度.
答案:
解析:
解析:
|
解: (1)n(FeS)= n(HCl)=0.20×2.0=0.40mol 由FeS+2H+=Fe2++H2S↑知盐酸过量,生成H2S 溶解H2S为n(H2S)溶=0.10×0.2=0.02mol 收集H2S为n(H2S)集=0.10-0.02=0.08mol V(H2S)集=0.08×22.4=1.79L (2)c(Fe2+)= c(H+)= |

练习册系列答案
相关题目
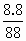 =0.10mol
=0.10mol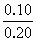 =0.50mol·L-1
=0.50mol·L-1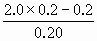 =1.0mol·L-1
=1.0mol·L-1
