题目内容
【题目】科学家设计了利用太阳能作动力,采用特殊电极及可循环利用的强酸性电解质电解二氧化碳和水来制取乙烯的方案,则下列说法错误的是
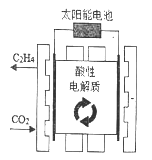
A. 太阳能是新能源,清洁、无污染
B. 电解过程中阳极区附近pH减小
C. 生成乙烯的电极反应为2CO2+12H+-12e-=4H2O+CH2=CH2
D. 通入二氧化碳的一极连接外接电源的负极
【答案】C
【解析】A. 太阳能是新能源,清洁、无污染正确,故不选;B. 电解过程中阳极区氢氧根离子失电子,产生氧气和水,所以附近pH减小,故B不选;C. 生成乙烯的电极反应为2CO2+12H++12e-=4H2O+CH2=CH2故C错;D.由2CO2+12H++12e-=4H2O+CH2=CH2 知,通入二氧化碳的一极作阴极,与连接外接电源的负极相连。故D不选;本题正确答案:C。

【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
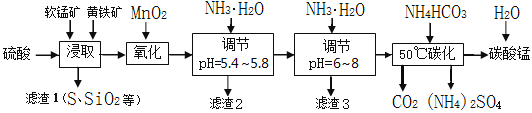
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。