题目内容
下列有关电解质的说法正确的是( )
| A、CO2、SO2、NH3、Na2O溶于水能导电,所以它们是电解质 |
| B、BaSO4、AgCl在水中溶解度很小,所以是弱电解质 |
| C、向醋酸溶液中加入氢氧化钠固体,溶液导电性增强 |
| D、向氨水中加水后,溶液中所有离子浓度都减小 |
考点:电解质与非电解质,强电解质和弱电解质的概念,弱电解质在水溶液中的电离平衡
专题:
分析:A、电解质在熔融状态或水溶液中能导电的化合物,非电解质是在熔融状态和水溶液中都不能导电的化合物;
B、BaSO4、AgCl是难溶的盐,熔融状态完全电离;
C、溶液导电能力与离子浓度成正比,氢氧化钠和醋酸反应生成醋酸钠属于强电解质;
D、将氨水稀释,碱性减弱,但是氢离子浓度增大.
B、BaSO4、AgCl是难溶的盐,熔融状态完全电离;
C、溶液导电能力与离子浓度成正比,氢氧化钠和醋酸反应生成醋酸钠属于强电解质;
D、将氨水稀释,碱性减弱,但是氢离子浓度增大.
解答:
解:A、CO2溶液导电是由于二氧化碳和水反应生成了碳酸的缘故,是非电解质,同理SO2、NH3是非电解质,Na2O是金属氧化物,在熔融状态下能导电,所以是电解质,故A错误;
B、BaSO4、AgCl是难溶的盐,投入水中,导电性较弱,但熔融状态完全电离;所以BaSO4、AgCl都是强电解质,故B错误;
C.加入NaOH固体,生成强电解质醋酸钠,促进醋酸电离,导致溶液中离子浓度增大,溶液导电性增强,故C正确;
D、将氨水稀释,碱性减弱,氢氧根离子浓度减小,但是氢离子浓度增大,故D错误;
故选C.
B、BaSO4、AgCl是难溶的盐,投入水中,导电性较弱,但熔融状态完全电离;所以BaSO4、AgCl都是强电解质,故B错误;
C.加入NaOH固体,生成强电解质醋酸钠,促进醋酸电离,导致溶液中离子浓度增大,溶液导电性增强,故C正确;
D、将氨水稀释,碱性减弱,氢氧根离子浓度减小,但是氢离子浓度增大,故D错误;
故选C.
点评:本题考查了电解质、非电解质概念,强电解质和弱电解质的概念,导电性强弱变化及弱电解质的电离平衡,难度不大,注意概念的理解.

练习册系列答案
相关题目
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2?2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 SO3 |
| D、3 mol SO2+0.5 mol O2+1 SO3 |
下列有关说法正确的是( )
| A、工业生产硫酸时,接触室中采用高温高压条件都能提高SO2和O2的转化率 |
| B、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水 |
| C、阴离子交换树脂可以除去硬水中的Ca2+、Mg2+ |
| D、工业上电解熔融AlCl3可制金属铝 |
 上海世博会某省馆设计标新立异,其外型是由三个大小不等的青花瓷容器组成(如图),陶姿是( )
上海世博会某省馆设计标新立异,其外型是由三个大小不等的青花瓷容器组成(如图),陶姿是( )| A、金属材料 | B、无机非金属材料 |
| C、复合材料 | D、合成材料 |
下列事实与氢键无关的是( )
| A、氨和水反应生成NH3?H2O |
| B、DNA双螺旋结构 |
| C、水在高温下分解成氢气和氧气 |
| D、乙醇比二甲醚易溶于水 |
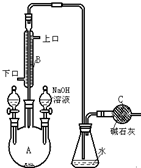 制备溴苯的实验装置如图所示,请回答下列问题:
制备溴苯的实验装置如图所示,请回答下列问题: +Br+→[
+Br+→[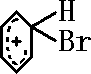 ];[
];[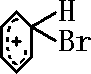 ]+FeBr4-→
]+FeBr4-→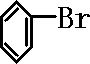 +HBr+FeBr3;
+HBr+FeBr3; +Br2→
+Br2→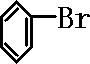 +HBr中的催化剂为
+HBr中的催化剂为