题目内容
| 反应时间t (h) | 1 | 4 | 9 | 16 | 25 |
| MgO膜厚Y (nm) | 0.02a | 0.08a | 0.18a | 0.32a | 0.50a |
| ZnO 膜厚Y (nm) | 1.0×10-3b | 4.0×10-3b | 9.0×10-3b | 1.6×10-2b | 2.5×10-2b |
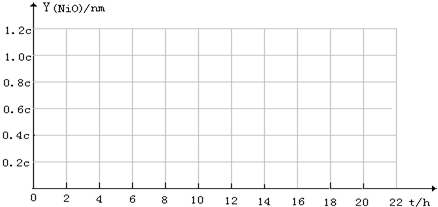
| NiO 膜厚Y (nm) | 0.3c | 0.6c | 0.9c | 1.2c | 1.5c |
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO:
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率:
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:
(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性:
(2)利用厚度除以时间计算;
(3)比较三种金属的氧化腐蚀速率,应在相同的条件下比较;
(4)镍的膜厚Y与时间t的函数关系式为y=0.3
| t |
(5)根据氧化膜的增长速率计算.
故答案为:Y=0.02at;Y=1.0×10-3bt;
(2)金属锌在此高温下1-25h内的氧化腐蚀速率为
| 2.5×10-2bnm |
| 25h |
故答案为:1.0×10-3b(nm/h);
(3)比较三种金属的氧化腐蚀速率,应在相同的条件下比较,除了温度相同外,氧气的浓度、固体的表面积和形状应相同,
故答案为:氧气的浓度(相等)和金属的表面积(相同)或金属的形状(相同);
(4)根据表中数据可得出镍的膜厚Y与时间t的函数关系式为y=0.3
| t |
 ,
,故答案为:

(5)镍的氧化膜生长曲线为抛物线型,氧化膜随时间增长较慢,故答案为:镍.

 阅读快车系列答案
阅读快车系列答案2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
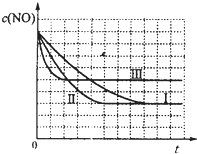
汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:

(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/xl0-4 mol L-1 |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
|
c(CO)/xl0-3 mol L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0 kJ • mol-1
2NO2 (g)  N2O4
(g)
△H=-56.9 kJ • mol-1
N2O4
(g)
△H=-56.9 kJ • mol-1
H2O(g) = H2O(l) △H=-44.0 kJ • mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。