题目内容
12.将1.92克铜粉与一定量的浓硝酸反应,当铜粉完全作用时,用排水法收集的气体在标况下的体积可能为( )| A. | 1.12L | B. | 0.56L | C. | 0.448L | D. | 0.224L |
分析 n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,铜粉完全作用时,用排水法收集的气体为NO,由电子守恒及V=nVm计算.
解答 解:铜粉与一定量的浓硝酸反应,当铜粉完全作用时,用排水法收集的气体为NO,整个过程中Cu失去电子,N得到电子,由电子守恒可知,n(NO)=$\frac{0.03mol×(2-0)}{(5-2)}$=0.02mol,其体积为0.02mol×22.4L/mol=0.448L,故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列有关元素周期表的说法正确的是( )
| A. | 元素周期表有7个横行,7个周期 | B. | 元素周期表有16个纵行,16个族 | ||
| C. | ⅠA 族的元素全部是金属元素 | D. | 0族元素的原子最外层都有8个电子 |
3.等物质的量的N2和CO一定含有相等的( )
①质量 ②体积 ③分子数 ④原子数.
①质量 ②体积 ③分子数 ④原子数.
| A. | ①② | B. | ③④ | C. | ①③④ | D. | ①②③④ |
20.某有机物结构简式如图所示,下列关于该化合物的说法正确的是( )


| A. | 属于芳香族化合物 | |
| B. | 分子式为C27H42 | |
| C. | 核磁共振氢谱证明分子中的5个甲基上的氢原子化学环境相同 | |
| D. | 不能使酸性KMnO4溶液褪色 |
17.下列反应属于放热反应的是( )
| A. | C与水蒸气在高温下反应制取水煤气 | |
| B. | CO2与C在高温下进行反应 | |
| C. | 加热分解碳酸钙 | |
| D. | 钠与水的反应 |
4.在标准状态下,把一定体积的CO2气体通入200mL1mol•L-1Ca(OH)2的澄清石灰水中,充分反应,生成沉淀10g,则通入CO2气体体积的是( )
| A. | 1.12L | B. | 3.36L | C. | 4.48L | D. | 6.72L |
17.关于下列各装置图的叙述中,正确的是( )


| A. | 用装置①精炼铜,则b为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连被保护,该方法叫做牺牲阳极的阴极保护法 | |
| D. | 装置④中的铁钉不容易被腐蚀 |

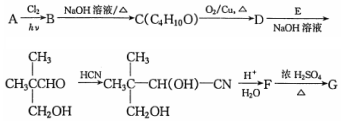
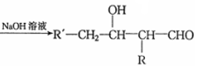
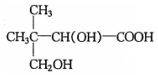 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$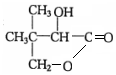 +H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为
+H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为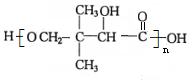 .
.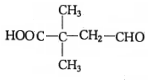 .
.