题目内容
11.在一定条件下,16g A和22g B恰好反应生成2mol C和12g D,则C的相对分子质量为13.分析 根据质量守恒定律计算16gA和22gB恰好反应生成C的质量,M=$\frac{m}{n}$计算C的摩尔质量,摩尔质量在数值上等于相对分子质量.
解答 解:16gA和22gB恰好反应生成C和12gD,根据质量守恒定律,生成C的质量为16g+22g-12g=26g,
故C的摩尔质量为$\frac{26g}{2mol}$=13g/mol,故C的摩尔质量为13g/mol,C的相对分子质量是13,故答案为:13.
点评 本题考查常用化学计量的有关计算、质量守恒定律等,难度不大.

练习册系列答案
相关题目
1. 金属锰在冶金工业和钢铁工业中均有重要作用.可用如图原理制备金属锰,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )
金属锰在冶金工业和钢铁工业中均有重要作用.可用如图原理制备金属锰,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )
 金属锰在冶金工业和钢铁工业中均有重要作用.可用如图原理制备金属锰,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )
金属锰在冶金工业和钢铁工业中均有重要作用.可用如图原理制备金属锰,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )| A. | M是电源的负极 | |
| B. | 右侧气孔逸出的气体为O2 | |
| C. | 阳极发生氧化反应 | |
| D. | 电解槽中发生的总反应为MnSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$MnO2+H2↑+H2SO4 |
2.下列电离方程式正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | Al2(SO4)3═2Al3++3SO42- | ||
| C. | H2SO4═H2++SO42- | D. | Ba(OH)2═Ba2++OH- |
19.下列粒子对水的电离平衡一定无影响的是( )
| A. | 比例模型为 的某有机分子 的某有机分子 | B. | 某离子 | ||
| C. | ${\;}_{11}^{23}$M+ | D. |  |
6.下列物质中,所含分子数目最多的是( )
| A. | 2g氢气 | B. | 16g氧气 | ||
| C. | 2mol Cl2 | D. | 6.02×1023个氯分子 |
16.根据下列反应,判断氧化剂的氧化性强弱顺序为( )
①H2S+Cl2═S+2HCl
②2NaI+Cl2═2NaCl+I2
③Na2S+I2═2NaI+S.
①H2S+Cl2═S+2HCl
②2NaI+Cl2═2NaCl+I2
③Na2S+I2═2NaI+S.
| A. | Cl2>I2>S | B. | Cl2>S>I2 | C. | I2>Cl2>S | D. | S>I2>Cl2 |
17.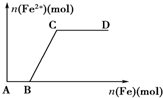 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )| A. | AB段铁元素以①形式存在 | B. | CD段铁元素以③形式存在 | ||
| C. | BC段铁元素以④形式存在 | D. | 以上说法均不正确 |
 ,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为
,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为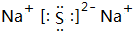 ,化合物中的化学键属于离子键.
,化合物中的化学键属于离子键.