题目内容
14.NA代表阿伏伽德罗常数,下列有关说法正确的是( )| A. | 含12.0g NaHSO4的溶液中含氧原子数为0.4NA | |
| B. | 若铁溶于稀硝酸中,转移电子数为0.3NA,则溶解的铁一定是5.6g | |
| C. | 若0.1NA个N2分子体积为2.48L,则它的所处条件不是标准状况,质量是2.8g | |
| D. | N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,若放出46.2kJ热量,断裂H-H键数目大于1.5NA |
分析 A.硫酸氢钠溶液中,硫酸氢钠、水都含有氧原子;
B.铁与足量硝酸反应生成硝酸铁,与少量硝酸反应生成硝酸亚铁;
C.0.1NA个氮气分子物质的量为0.1mol,依据V=nVm,m=nM计算解答;
D.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol表示生成2mol氨气放出热量92,4KJ,消耗3mol氢气.
解答 解:A.硫酸氢钠溶液中,硫酸氢钠、水都含有氧原子,硫酸氢钠含量未知,无法计算氧原子个数,故A错误;
B.若铁溶于稀硝酸中,转移电子数为0.3NA,则溶解的铁可能大于或者等于5.6g,故B错误;
C..0.1NA个氮气分子物质的量为0.1mol,标况下体积为0.1mol×22.4L/mol=2.24L,质量m=0.1mol×28g/mol=2.8g,故C正确;
D.若放出46.2kJ热量,则消耗氢气的物质的量为1.5mol,断裂H-H键数目等于1.5NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握以物质的量为核心的有关计算公式是解题关键,注意对气体摩尔体积使用条件和对象,注意铁与硝酸反应生成产物的判断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列物质露置在空气中,成分不会发生变化的是( )
| A. | Na2O2 | B. | FeCl2 | C. | 漂白粉 | D. | Na2CO3 |
5.以下物质间的转化不能通过一步反应实现的是( )
| A. | HClO→O2 | B. | SiO2→H2SiO3 | C. | CO2→CaCO3 | D. | Cu→CuSO4 |
2.下列有关自然界中氮循环(如图)的说法不正确的是( )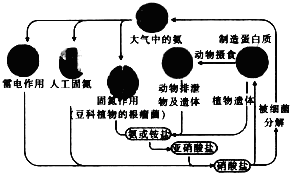

| A. | 含氮无机物和含氮有机物可相互转化 | |
| B. | 通过闪电产生NO属于高能固氮 | |
| C. | 硝酸盐被细菌分解为氮气过程氮元素一定被氧化 | |
| D. | C、H、O也参与自然界中氮循环 |
9.下列说法错误的是( )
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化得到汽油 | |
| C. | 石油的裂解是化学变化,石油的分馏是物理变化 | |
| D. | 石油裂解气的主要成分是各种烯烃,并不含有烷烃 |
10.用NA表示阿伏加德罗常数,下列说正确是( )
| A. | 标准状况下,22.4LCC14含有的分子数为NA | |
| B. | 常温常压下,17gNH3所含的原子数目为4NA | |
| C. | 1molNa2O2与H20完全反应,转移2NA个电子 | |
| D. | O.lmol/LNa2CO3溶液中含有的Na+数目为0.2NA |
7.我国科学家屠呦呦因发明抗疟新药青蒿素(分子式:C15H22O5)荣获2015年诺贝尔医学奖.青蒿素属于( )
| A. | 混合物 | B. | 有机物 | C. | 氧化物 | D. | 单质 |

 .
.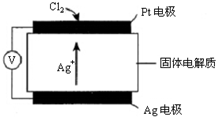 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.