题目内容
常温下,往NH4NO3溶液加人少量Na2O固体,溶液中微粒的数目不变的是
| A.NH4+ | B.H+ | C.NO3- | D.H2O |
C
试题分析:Na2O是碱性氧化物,与水反应生成NaOH;NaOH是强碱,与NH4NO3反应生成NaNO3、NH3和H2O;A、由于NH4++OH—=NH3↑+H2O,故NH4+数目减少,错误;B、Na2O+H2O=2Na++2OH—,故溶液中OH—数目增多,由于Kw=c(OH—)?c(H+)不变,则溶液中H+数目减少,错误;C、硝酸根没有参加离子反应,故其数目不变,正确;D、水与氧化钠反应,水分子数目减少,错误。

练习册系列答案
相关题目
 Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O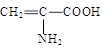

 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
 、
、 、
、