题目内容
【题目】已知AG=lg![]() ,电离度α=
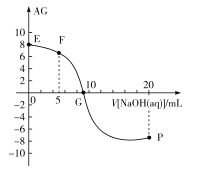
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
【答案】C
【解析】
E点为0.1mol/LHX溶液,AG=lg![]() =8,则
=8,则![]() =108,水的离子积KW=
=108,水的离子积KW=![]() =10-14,由此计算氢离子浓度;
=10-14,由此计算氢离子浓度;
F点为等物质的量HX溶液NaX溶液的混合液,此时AG=lg![]() =6,则c(H+)>c(OH-),pH<7;
=6,则c(H+)>c(OH-),pH<7;
G点为AG=lg![]() =0,则c(H+)=c(OH-);
=0,则c(H+)=c(OH-);
V=10时溶液为NaX溶液,由于水解和水的电离c(OH-)>c(HX)。
A. F点为等物质的量HX溶液NaX溶液的混合液,此时AG=lg![]() =6,则c(H+)>c(OH-),pH<7,故A正确;
=6,则c(H+)>c(OH-),pH<7,故A正确;
B. G点溶液中AG=lg![]() =0,则c(H+)=c(OH-),溶液中存在电荷守恒c(H+)+ c(Na+)=c(OH-)+ c(X-),故c(Na+)=c(X-)>c(H+)=c(OH-),故B正确;
=0,则c(H+)=c(OH-),溶液中存在电荷守恒c(H+)+ c(Na+)=c(OH-)+ c(X-),故c(Na+)=c(X-)>c(H+)=c(OH-),故B正确;
C.V=10时溶液为NaX溶液,由于水解和水的电离c(OH-)>c(HX),故C错误;
D.E点为0.1mol/LHX溶液,AG=lg![]() =8,则
=8,则![]() =108,水的离子积KW=
=108,水的离子积KW=![]() =10-14,
=10-14, ![]() ,则电离度=
,则电离度=![]() ,故D正确;
,故D正确;
故答案选:C。

【题目】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190Kj/mol
2SO3(g) ΔH=-190Kj/mol
①下列描述中能说明上述反应已达平衡的是____________。
a. ![]() (O2)正=2
(O2)正=2![]() (SO3)逆 b.容器中气体的密度不随时间而变化
(SO3)逆 b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化 d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则![]() (O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
(O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol3) <_____mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2(g) ![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH_______0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。

③右图中的B点对应的NH3的平衡转化率为___________。