题目内容
某课外活动小组的同学,在实验室研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题。
(1)这样制取的二氧化硫气体中可能含有的杂质是 。
(2)某同学用下列装置连接成一整套实验装置以验证(1)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是 (用a、b……填写)。

(3) 根据(2)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
|
装置 |
所盛药品 |
实验现象 |
结论或解释 |
|
B |
|
|
|
|
C |
CuO固体 |
|
|
【答案】
(1) 氢气和水蒸气 (2)c d (或d c) a b (或b a) e
(3)
|
装置 |
所盛药品 |
实验现象 |
结论或解释 |
|
B |
无水硫酸铜 |
固体由白色变成蓝色 |
SO2中含有水蒸气 |
|
C |
|
固体由黑色变成红色 |
SO2中含有氢气 |
【解析】(1)由于在反应过程中,浓硫酸的密度会逐渐减小,所以在反应后期会产生氢气。又因为气体从溶液中挥发出时一定会带有水蒸气,即SO2中含有的杂质是氢气和水蒸气。
(2)检验氢气可用其还原性,即利用氢气还原氧化铜;检验水蒸气一般用无水硫酸铜,且首先要检验水蒸气;又因为氢气在还原氧化铜时应该是干燥的,所以正确的答案是c d (或d c) a b (或b a) e
(3)见分析(2).

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
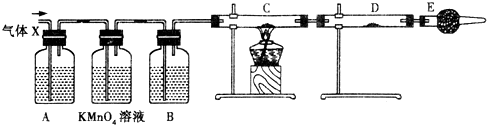
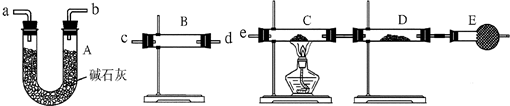
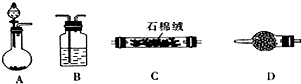
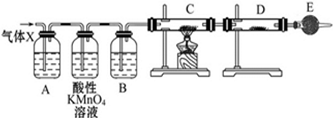 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答:
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答: