题目内容
10.计算:0.7g某气体的体积为560mL,则该气体的相对分子质量是多少?分析 结合n=$\frac{V}{Vm}$、M=$\frac{m}{n}$及摩尔质量与相对分子质量的数值相等计算.
解答 解:气体的物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,气体的M=$\frac{0.7g}{0.025mol}$=28g/mol,则该气体的相对分子质量是28,
答:该气体的相对分子质量是28.
点评 本题考查物质的量的计算,为高频考点,把握物质的量、质量、体积的关系为解答的关键,侧重分析与计算能力的考查,注意摩尔质量与相对分子质量的数值相等,题目难度不大.

练习册系列答案
相关题目
20.对1mol/L的Na2SO4(摩尔质量为142g/mol)溶液的叙述中正确的是( )
| A. | 溶液中含有1mol的Na2SO4 | |
| B. | 从1L溶液中取出500 mL后,剩余溶液的浓度变为0.5mol/L | |
| C. | 1mol的Na2SO4 溶于1L水 | |
| D. | 1L溶液中含有142 g Na2SO4 |
1.溶液、胶体和浊液这三种分散系的本质区别是( )
| A. | 分散质的粒子是否为大量分子或离子的集合体 | |
| B. | 能否透过滤纸 | |
| C. | 分散质粒子直径的大小 | |
| D. | 是否均一、稳定 |
18.下列物质:HCHO(甲醛)、MgSO4、NH4Cl、Hg(NO3)2中,能使蛋白质变性的是( )
| A. | 甲醛 | B. | MgSO4 | C. | NH4Cl | D. | Hg(NO3)2 |
5.物质的量符号为( )
| A. | M | B. | m | C. | n | D. | V |
15.把铝粉和Fe3O4粉末配成铝热剂,并均分成两等份,前一份在高温下恰好完全反应,然后将生成物与足量的盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成气体在相同状况下的体积比为( )
| A. | 1:1 | B. | 9:8 | C. | 3:4 | D. | 4:3 |
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在常温常压下,11.2L Cl2含有的分子数为0.5 NA | |
| B. | 标准状况下,11.2 L H2O 中含有的分子数目为0.5NA | |
| C. | 0.10 mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10 NA | |
| D. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3 NA |
14.向一定质量的稀盐酸中加入镁粉至过量,图中横坐标表示镁粉的质量,则纵坐标表示( ) 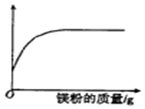

| A. | 溶液的质量 | B. | 稀盐酸的质量 | C. | 氯化镁的质量 | D. | 生成气体的质量 |