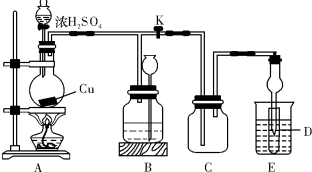
题目内容
某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体和胆矾晶体.其实验方案如下:

(1)所加试剂①、②分别是______、______.
(2)从滤液E中得到绿矾晶体的实验操作是______;从滤渣F制取胆矾的第一步操作最好采用______.
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由______、______.
你认为正确的设计方案是______.
解:(1)金属铝和氢氧化钠反应,加入NaOH溶液后金属铝溶解生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,
铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,故答案为:NaOH溶液;稀硫酸;
(2)滤液E中含硫酸亚铁溶液,要得到硫酸亚铁晶体,要经过蒸发浓缩、冷却结晶,考虑到亚铁离子易被氧化,应隔绝空气防氧化.
滤渣F中含铜,由铜制取硫酸铜,从环保角度考虑,采用铜与氧气反应不会产生污染物,然后用硫酸溶解氧化铜得硫酸铜.
故答案为:在隔绝空气的条件下,蒸发浓缩、冷却结晶;将滤渣F在空气中灼烧;
(3)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,
会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,故答案为:由滤液A制得氯化铝溶液不合理,
所得氯化铝溶液中含有大量NaCl杂质 向滤液A中通入足量的CO2得Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解.
分析:根据金属的性质结合框图转化关系和所得产品选择合适的试剂.
由滤液A→AlCl3可知,滤液A中含有溶解的铝元素,根据铝既与酸反应又与碱反应可知,试剂①为氢氧化钠溶液.铁、铜与氢氧化钠不反应,所以滤渣B为铁、铜.根据产品绿矾,可知试剂②为稀硫酸,所以滤液E为硫酸亚铁溶液,滤渣F为铜.铜到硫酸铜,可用浓硫酸与铜加热制取,但会产生污染气体二氧化硫,所以采用铜先与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜的方法.
(1)金属铝和氢氧化钠反应,而金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应而金属铜不反应;
(2)从滤液中析出晶体的操作;从环保角度和试剂用量考虑;
(3)从制备过程中是否会引入杂质分析考虑.
点评:本题是对物质的分离和提纯知识点的考查,题目难度不是很大,要注意从框图转化中找出有用信息.
铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,故答案为:NaOH溶液;稀硫酸;
(2)滤液E中含硫酸亚铁溶液,要得到硫酸亚铁晶体,要经过蒸发浓缩、冷却结晶,考虑到亚铁离子易被氧化,应隔绝空气防氧化.
滤渣F中含铜,由铜制取硫酸铜,从环保角度考虑,采用铜与氧气反应不会产生污染物,然后用硫酸溶解氧化铜得硫酸铜.
故答案为:在隔绝空气的条件下,蒸发浓缩、冷却结晶;将滤渣F在空气中灼烧;
(3)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,
会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,故答案为:由滤液A制得氯化铝溶液不合理,
所得氯化铝溶液中含有大量NaCl杂质 向滤液A中通入足量的CO2得Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解.
分析:根据金属的性质结合框图转化关系和所得产品选择合适的试剂.
由滤液A→AlCl3可知,滤液A中含有溶解的铝元素,根据铝既与酸反应又与碱反应可知,试剂①为氢氧化钠溶液.铁、铜与氢氧化钠不反应,所以滤渣B为铁、铜.根据产品绿矾,可知试剂②为稀硫酸,所以滤液E为硫酸亚铁溶液,滤渣F为铜.铜到硫酸铜,可用浓硫酸与铜加热制取,但会产生污染气体二氧化硫,所以采用铜先与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜的方法.
(1)金属铝和氢氧化钠反应,而金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应而金属铜不反应;
(2)从滤液中析出晶体的操作;从环保角度和试剂用量考虑;
(3)从制备过程中是否会引入杂质分析考虑.
点评:本题是对物质的分离和提纯知识点的考查,题目难度不是很大,要注意从框图转化中找出有用信息.

练习册系列答案
相关题目