题目内容
用如图装置可以完成一系列实验(图中夹持装置已略去):

若装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊试液、④蘸有浓NaOH溶液.
(1)p中盛装的试剂为______.
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:______.①处包有的某固体物质可能是______(填字母).
A.MnO2B.KMnO4C.KCl D.Cu
(3)在整个实验过程中,在③处能观察到的现象为______.
(4)反应较长时间后,②处棕黄色褪去,生成无色的 ,写出该反应的离子方程式:______.
,写出该反应的离子方程式:______.
解:(1)因浓硫酸和浓盐酸混合时,为了使热量散发,应将浓硫酸缓慢加入到浓盐酸中,故答案为:浓硫酸;
(2)有棕黄色物质确定为单质碘,卤素单质间能发生置换反应:Cl2+2KI=2KCl+I2,因通过①后生成了Cl2,而KMnO4溶液能氧化HCl得到Cl2,所以某固体物质可能是KMnO4,故答案为:Cl2+2I-=2Cl-+I2;b;
(3)因Cl2能与水反应生成HCl和HClO,HCl具有酸性,能使石蕊溶液变红,HClO具有强氧化性能使红色褪去,故答案为:先变红后褪色;
(4)②处有棕黄色褪去,生成无色的IO3-,碘的化合价升高,则氯元素和化合价降低为-1价,化学方程式为:
5Cl2+I2+6H2O=2HIO3+10HCl,离子方程式为:5Cl2+I2+6H2O=12H++2IO3-+10Cl-,
故答案为:5Cl2+I2+6H2O=12H++2IO3-+10Cl-.
分析:(1)根据浓硫酸稀释的方法将浓硫酸往水中倒;
(2)先根据有棕黄色物质确定为单质碘,再根据卤素单质间能发生置换反应;由通过①后生成了Cl2,再根据KMnO4溶液能氧化HCl得到Cl2;
(3)根据Cl2能与水反应生成HCl和HClO,HCl具有酸性和HClO具有强氧化性;
(4)根据实验现象和氧化还原反应中化合价升降总数相等来解答;
点评:本题主要结合实验考查了物质的性质,能够根据实验现象判断物质的性质,离子反应的现象分析判断是解题关键,题目难度中等.
(2)有棕黄色物质确定为单质碘,卤素单质间能发生置换反应:Cl2+2KI=2KCl+I2,因通过①后生成了Cl2,而KMnO4溶液能氧化HCl得到Cl2,所以某固体物质可能是KMnO4,故答案为:Cl2+2I-=2Cl-+I2;b;
(3)因Cl2能与水反应生成HCl和HClO,HCl具有酸性,能使石蕊溶液变红,HClO具有强氧化性能使红色褪去,故答案为:先变红后褪色;
(4)②处有棕黄色褪去,生成无色的IO3-,碘的化合价升高,则氯元素和化合价降低为-1价,化学方程式为:
5Cl2+I2+6H2O=2HIO3+10HCl,离子方程式为:5Cl2+I2+6H2O=12H++2IO3-+10Cl-,
故答案为:5Cl2+I2+6H2O=12H++2IO3-+10Cl-.
分析:(1)根据浓硫酸稀释的方法将浓硫酸往水中倒;
(2)先根据有棕黄色物质确定为单质碘,再根据卤素单质间能发生置换反应;由通过①后生成了Cl2,再根据KMnO4溶液能氧化HCl得到Cl2;
(3)根据Cl2能与水反应生成HCl和HClO,HCl具有酸性和HClO具有强氧化性;
(4)根据实验现象和氧化还原反应中化合价升降总数相等来解答;
点评:本题主要结合实验考查了物质的性质,能够根据实验现象判断物质的性质,离子反应的现象分析判断是解题关键,题目难度中等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目


 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).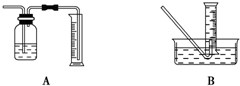
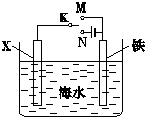 (1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于 已知A、B、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如下所示转化关系(部分产物及反应条件已略去)
已知A、B、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如下所示转化关系(部分产物及反应条件已略去)
 小明买了一种“汽泡爽”的冲调饮料.
小明买了一种“汽泡爽”的冲调饮料.