题目内容
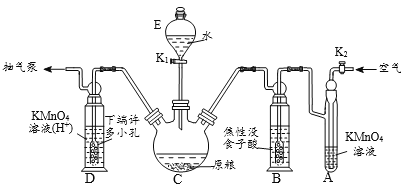
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
(1)若D为硫酸,则B的化学式是______。
(2)若D为硝酸,则C的颜色为______;C转化为B的反应方程式为____________。
(3)欲分离硫酸和硝酸的混合溶液,可采取的分离方法是______。
(4)有一硫酸和硝酸的混合溶液,取出100mL加入足量BaCl2溶液,过滤,洗涤,烘干后得到93.2g沉淀:滤液与4mol/LNaOH溶液反应,消耗400mLNaOH溶液时恰好完全中和。计算可得:
①混合溶液中硝酸的物质的量浓度为______;
②另取100mL原混合溶液稀释至200mL,成为稀酸,加入44.8g铜粉共热,收集到的气体在标准状况下的体积为______。
【答案】 SO2 红棕色 3NO2+H2O=2HNO3+NO (减压)蒸馏 8mol/L 8.96L
【解析】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,则A是氮气或单质硫,据此解答。
(4)①硫酸与硝酸的混合溶液,取出100mL加入足量BaCl2溶液,生成硫酸钡沉淀,根据硫酸钡的物质的量计算硫酸的物质的量;滤液中氢离子物质的量不变,与NaOH溶液恰好完全中和,结合氢离子与氢氧根的物质的量相等计算硫酸、硝酸的物质的量浓度;
②发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,先判断过量情况,然后根据不足量计算。
(1)若D为硫酸,则A是单质硫,B是二氧化硫,C是三氧化硫,二氧化硫的化学式是SO2。
(2)若D为硝酸,则A是氮气,B是NO,C是NO2,NO2的颜色为红棕色,二氧化氮溶于水生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO。
(3)硝酸和硫酸的沸点不同,需要蒸馏分离。但由于硝酸受热易分解,所以欲分离硫酸和硝酸的混合溶液,可采取的分离方法是(减压)蒸馏。
(4)①硫酸与硝酸的混合溶液,取出100mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到93.2g的沉淀为硫酸钡,硫酸根守恒故n(H2SO4)=n(BaSO4)=93.2g÷233g/mol=0.4mol;滤液中氢离子物质的量不变,与4molL-1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,故n(HNO3)+2n(H2SO4)=n(NaOH),即n(HNO3)+2×0.4mol=0.4L×4mol/L,解得n(HNO3)=0.8mol,故原溶液中c(HNO3)=0.8mol÷0.1L=8mol/L;
(2)44.8gCu的物质的量为44.8g÷64g/mol=0.7mol,溶液中H+离子的物质的量为1.6mol,溶液中含有NO3-的物质的量为:0.1L×8mol/L=0.8mol,发生反为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3mol 8mol 2mol 44.8L
0.7mol 1.6mol 0.8mol V
1.6molH+完全反应消耗0.4molNO3-、0.6molCu,显然H+不足,所以生成NO的体积按照氢离子的物质的量计算,则V=1.6mol×44.8L/8mol=8.96 L。

【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .