题目内容
【题目】2013年,“雾霾”成为年度关键词。近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题:雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(I)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4-7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用子染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:____________。
(2)SO2经过净化后与空气混合进行催化氧化后制取硫酸我者硫酸铵,其中SO2发生催化氧化的反应为:2 SO2 (g)+ O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
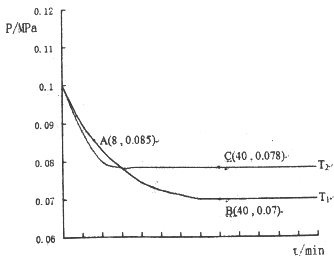
①图中A点时,SO2的转化率为____________。
②计算SO2催化氧化反应在图中B点的压强平衡常数K=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则Tl__T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率VA(逆)的大小关系为vc(正)____VA(逆)(填“>”、“<”、“=”)
【答案】 2HSO3-+ 2H++2e- = S2O42-+2H2O 45% 24300 (Mpa)-1 < >
【解析】(I)电解:阴极上得电子,发生还原反应,2HSO3-+2H++2e-=S2O42-+2H2O;(2)①列出三段式,设氧气消耗物质的量为x,
2SO2(g)+O2(g)![]() 2SO3
2SO3
起始量/mol 2a a 0
变化量/mol 2x x 2x
平衡/mol 2a-2x a-x 2x
图中A点时,气体物质的量0.085,则(2a-2x+a-x+2x)/(2a+a)=0.085/0.1,x=0.45a,SO2的转化率=0.45a×2/2a×100%=45%;②图中B点,列出三段式,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量/mol 2a a 0
变化量/mol 2y y 2y
平衡量/mol 2a-2y a-y 2y
B点气体物质的量为 0.007,则(2a-2y+a-y+2y)/(2a+a)=0.07/0.1,y=0.9a,平衡常数K=((0.007×1.8/(0.2a+0.1a+1.8a))2(0.007×0.2a/(0.2a+0.1a+1.8a))-2×(0.007×0.1a/(0.2a+0.1a+1.8a))-1=24300(MPa)-1。即K=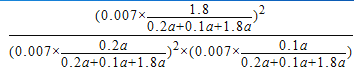 =24300(MPa)-1。③图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)。
=24300(MPa)-1。③图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)。

