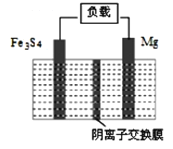
题目内容
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_______________。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:________________(用离子方程式表示)。溶液中所含离子浓度由大到小的顺序为______________。
(4)YX4M的电子式为______________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为_________________________________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为______________。
【答案】第三周期ⅠA族Cl->O2->Mg2+NH4++H2O![]() NH3·H2O+H+c(NO3-)>c(NH4+)>c(H+)>c(OH-)
NH3·H2O+H+c(NO3-)>c(NH4+)>c(H+)>c(OH-)![]() Mg3N2+6H2O===3Mg(OH)2+2NH3↑Cl2+2OH-==ClO-+Cl-+H2O
Mg3N2+6H2O===3Mg(OH)2+2NH3↑Cl2+2OH-==ClO-+Cl-+H2O
【解析】
X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,故X为H元素;Y的气态氢化物能使湿润的红色石蕊试纸变蓝,故为氨气,则Y为N元素;Z为地壳中含量最多的元素,故Z为O元素;R与X同主族,且原子序数大于8,故R为Na元素;Y、R、Q最外层电子数之和为8,故Q的最外层有2个电子,且原子序数比11大,故为Mg元素;M的单质黄绿色有害气体,故M为Cl元素。
(1)R为Na元素,其原子序数为11,位于周期表中第三周期第IA族;
(2)Z、Q、M简单离子分别为O2-、Mg2+、Cl-,而微粒的电子层数越多,则半径越大,故Cl-的半径最大;当电子层数相同时,核电荷数越多,则半径越小,故Mg2+的半径最小,故简单离子半径由大到小的顺序为Cl->O2->Mg2+;
(3) H、N、O三种元素形成的盐类化合物为NH4NO3,溶液呈酸性,其原因是铵根离子水解,离子方程式为:NH4++H2O![]() NH3·H2O+H+;溶液中所含离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-) ;
NH3·H2O+H+;溶液中所含离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-) ;
(4) H、N、Cl形成的化合物为NH4Cl,为离子化合物,其电子式为 ;
;
Q3Y2为Mg3N2,在水溶液中发生双水解生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O===3Mg(OH)2+2NH3↑;
(5)M的单质即为氯气,与R的最高价氧化物对应的水化物即为NaOH反应,生成氯化钠、次氯酸钠和水,反应的离子方程式为: Cl2+2OH-==ClO-+Cl-+H2O。

【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应![]() Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)![]()
![]() Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
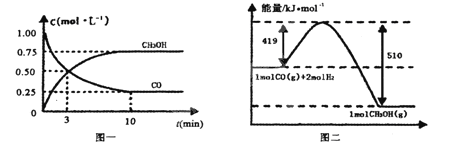
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 | CH3OH的浓度 | 能量变化 |
甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
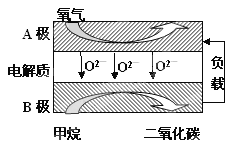
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。