题目内容
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,________ 与盐酸反应的速度最慢。实验结论为:_____________________________。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________。
Ⅱ. 利用下图装置可验证同主族元素非金属性的变化规律。
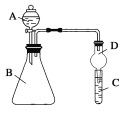
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液_____________________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_________溶液的洗气瓶除去。
【答案】钠 铝 同周期元素,从左到右元素金属性减弱 S2-+Cl2===S↓+2Cl- 变蓝 NaOH 有白色沉淀生成 饱和NaHCO3
【解析】
(1)根据同周期自左向右金属性逐渐减弱分析解答;
(2)氯气和硫化钠反应生成氯化钠和单质硫,据此书写;
(3)根据氯气能把碘化钾氧化为单质碘分析;根据氯气有毒需要尾气处理分析;
(4)根据较强酸制备较弱酸分析;根据生成的二氧化碳中含有氯化氢会干扰实验分析。
(1)根据金属活动性顺序:钠>镁>铝,相同条件下与盐酸反应最激烈的是钠,反应速率最慢的是铝,因此实验结论是同周期元素,从左到右元素金属性减弱;
(2)氯气氧化性大于硫单质,所以氯气能够与硫离子反应生成单质硫,反应的离子方程式为S2-+Cl2=S↓+2Cl-;
(3)KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,碘遇淀粉试液变蓝色,观察到C中无色溶液变蓝;过量的氯气会逸散到空气中,污染环境,可用碱液NaOH溶液吸收尾气。
(4)碳酸和硅酸钠反应生成硅酸沉淀和碳酸钠,所以C中有白色沉淀生成;碳酸钙和盐酸反应是放热反应,放出的热量促进氯化氢挥发,导致制取的二氧化碳中含有HCl,HCl和硅酸钠反应生成硅酸,从而对二氧化碳产生干扰,不能说明是二氧化碳与Na2SiO3反应生成白色沉淀,为防止干扰,用饱和的碳酸氢钠溶液除去HCl,所以应在两装置间添加装有饱和NaHCO3溶液的洗气瓶除去。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案【题目】用焰色反应检验K+时有如下操作步骤:①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察,④用稀盐酸洗净铂丝。其中正确的操作顺序为( )
A.①②③④
B.④①②③
C.④②①②③
D.①③②④
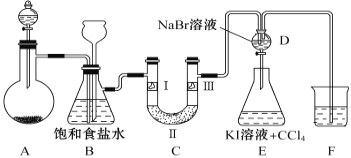
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。