题目内容
7.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
分析 (1)过滤除去不溶杂质,若温度冷却,硫化钠会结晶析出而损失;
(2)盛放Na2SO3固体的玻璃仪器是蒸馏烧瓶,三颈烧瓶内反应结束会有未反应的二氧化硫,直接排放会污染空气;
(3)①用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点
②终点读数与起点读数之差为消耗碘的标准溶液体积,根据方程式计算
③局部变色就停止滴定,消耗标准溶液体积偏小,测定结果偏低.
解答 解:(1)过滤除去不溶杂质,若温度冷却,硫化钠会结晶析出而损失,
故答案为:防止硫化钠结晶析出而损失、去除杂质;
(2)盛放Na2SO3固体的玻璃仪器是蒸馏烧瓶,三颈烧瓶内反应结束会有未反应的二氧化硫,装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫是污染性气体不能排放到空气中,以防止污染空气,
故答案为:蒸馏烧瓶;吸收SO2等尾气,防止污染;
(3)①用配制的碘溶液滴定硫代硫酸钠,滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色,说明反应到达终点,
故答案为:滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②终点读数为18.10mL,起点读数为0.00mL,故消耗碘的标准溶液体积为18.10mL,
设Na2S2O3•5H2O的纯度为x,则:
2Na2S2O3•5H2O~2Na2S2O3~I2
2M g 1mol
Wxg 18.10×10-3L×0.1000 mol•L-1
故2M g:Wx g=1mol:18.10×10-3L×0.1000 mol•L-1
解得x=$\frac{0.362M}{W}$%,
故答案为:18.10;$\frac{0.362M}{W}$%;
③局部变色就停止滴定,消耗标准溶液体积偏小,会使样品中Na2S2O3•5H2O的纯度的测量结果偏低,
故答案为:偏低.
点评 本题考查实验方案方案,涉及探究温度和浓度对反应速率的影响、物质实验制备、氧化还原反应滴定等,是对学生综合能力的考查,难度中等.

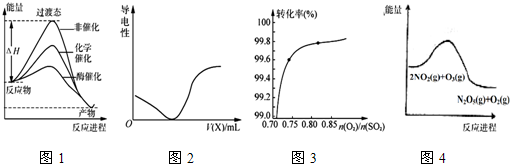
| A. | 由图1所示曲线可知,化学催化比酶催化的效果好 | |
| B. | 在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2 | |
| C. | 其它条件不变,关于反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),图3中纵坐标表示O2的转化率 | |
| D. | 图4的反应升高温度,平衡常数减小 |
| A. | 硝酸和氢氧化钠 | B. | 氢氧化铁和盐酸 | C. | 氢氧化钡和硫酸 | D. | 碳酸氢钠和盐酸 |
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
| A. | 卤素都是活泼的金属元素 | |
| B. | 卤素是常见的成盐元素,都是氧化剂 | |
| C. | 卤素原子最外层都有7个电子 | |
| D. | 卤化氢、卤化银的性质都有相似之处 |
| A. | 在常温、常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 标准状况下,18g H2O的体积是22.4L | |
| C. | NA个SO2的体积是22.4L | |
| D. | 标准状况下,22.4L H2 与O2的混合气体所含原子数为2NA |
 某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?
某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?