题目内容
某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则
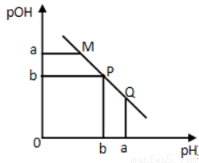
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
下列实验中,对应的现象及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 在未知溶液中滴加BaCl2溶液出现白色沉淀,再加稀硝酸 | 沉淀不溶解 | 该未知溶液存在SO42-或SO32- |
B | 向稀的苯酚水溶液中滴加少量溴水 | 先看到白色沉淀,后消失 | 生成的三溴苯酚又重新溶于苯酚溶液中 |
C | 向某溶液中加入几滴新制的氯水,再向溶液中加入2滴KSCN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
D | 在相同温度下,向1mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 先产生白色沉淀,后生成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Mg(OH)3] |
利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO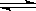 2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) /×10-3 mol·L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO) / ×10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |


 下列说法中,不正确的是
下列说法中,不正确的是
 A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
 B.在该温度下,反应的平衡常数K=5
B.在该温度下,反应的平衡常数K=5
 C.若将容积缩小为原来的一半,NO转化率大于90%
C.若将容积缩小为原来的一半,NO转化率大于90%
 D.使用催化剂可以通过提高活化分子百分数提高单位时间CO和NO的处理量
D.使用催化剂可以通过提高活化分子百分数提高单位时间CO和NO的处理量


 B.
B.
 D.
D.
 先增大再减小
先增大再减小
 ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。